
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA | |
| D. | 将0.1mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第四周期元素的基态原子中,Cr元素的未成对电子数最多 | |
| B. | 第三周期元素中3p原子轨道有一个未成对电子的原子有2种 | |
| C. | 核外电子数为偶数的基态原子,其原子轨道中可能含有“未成对电子” | |
| D. | 基态碳原子无未成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从溴水中萃取溴,可用酒精做萃取剂 | |
| B. | 蒸发实验完毕后,发现蒸发皿炸裂,这是因为没有垫石棉网 | |
| C. | 萃取碘水溶液中碘,分离碘四氯化碳溶液时,眼睛注视分液漏斗里液面 | |
| D. | 蒸馏时,为了加快水的流速,水应从上口进入,下口流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+═Zn2++Fe | |
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe+2Fe3+═3Fe2+ | Fe3+具有氧化性 | |
| ④ | (不写) | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
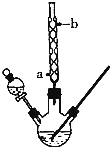 某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:| 乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
| 熔点/℃ | -117.3 | 16.6 | -83.6 | - |
| 沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
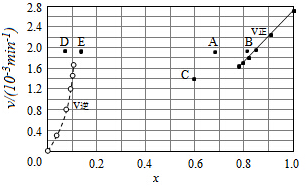 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com