
【题目】下列图示与对应的叙述相符的是
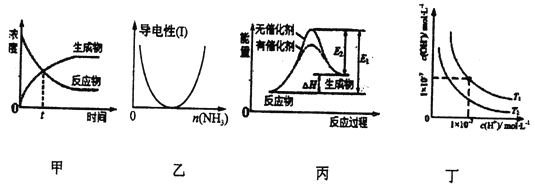
A. 图甲表示可逆反应物质的浓度随时间的变化,且在t时刻达到平衡
B. 图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液的导电性变化
C. 图丙表示某吸热反应分别在有、无催化剂的情况下,反应过程中的能量变化
D. 图丁表示不同温度下水溶液中H+和OH-浓度的变化曲线,图中温度T1<T2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应:mA(g)+nB(s)![]() pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.5倍,下列说法错误的是( )
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.5倍,下列说法错误的是( )
A.m+n<p B.平衡向左反应方向移动
C.B的转化率降低 D.A的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
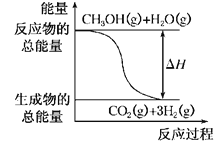
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是( )
A.CH3OH的燃烧热为-192.9 kJ·mol-1
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.由②推知反应CH3OH(l)+![]() O2(g)=CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g)ΔH >-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将 pH=3 的硫酸与 pH=9 的 NaOH 溶液混合,若要得到 pH = 7 的溶液,混合时硫酸与 NaOH 溶液的体积比为( )
A.1: 200 B. 200 : 1 C. 100 : 1 D.1:100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定类似,是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0. 00lmol/L酸性KMnO4溶液滴定未知浓度的NaHSO3溶液,请回答下列问题:
(1)完成滴定的离子方程式(在__中填系数,在___上填物质或离子):_____
____MnO4-+____HSO3-+____=____Mn2++___ ____+___H2O
(2)该滴定实验的仪器除了铁架台、滴定管夹外,还需要下列用品中的_____(填序号)
A.酸式滴定管 B.碱式滴定管 C.漏斗 D.锥形瓶 E.烧杯 F.白纸
(3) KMnO4溶液不能用____(酸、碱)式滴定管盛装,原因是:_______。
(4)是否需要选择指示剂?_____。滴定终点的现象是___________。
(5)滴定前平视KMnO4液面,刻度为amL,滴定后俯视液面刎度为bmL,则(b-a)mL比实际消耗KMnO4溶液体积_______(填“大”、“小”或“无影响”,下同)。根据(b-a) mL计算,得到NaHSO3的浓度比实际的浓度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地酸雨检验除含H+外[c(OH﹣)可忽视]还有Na+,Cl﹣,NH4+,SO42﹣其浓度依次为:c(Na+)=2.3×10﹣5mol/L,c(Cl﹣)=3.5×10﹣5mol/L,c(NH4+)=2.3×10﹣5mol/L,c(SO42﹣)=1.05×10﹣5mol/L,则该地酸雨的pH为( )
A. 3 B. 4 C. 5 D. 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为0.5 L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色) ![]() N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
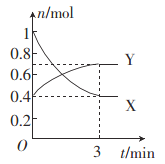
(1)曲线____(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)在0~3 min内,用NO2表示的反应速率为____________。
(3)下列叙述能说明该反应已达到化学平衡状态的是________(填字母)。
a.容器内压强不再发生变化
b.NO2的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolN2O4的同时生成2nmol NO2
(4)反应达到平衡后,若降低温度,则v(正)______,v(逆)________。(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化碳生产化工产品,有利于二氧化碳的大量回收,二氧化碳和乙二醇在ZnO或锌盐催化下可合成碳酸乙烯酯。
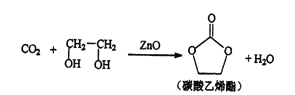
(1)锌基态原子核外电子排布式为_________________。
(2)锌盐水溶液中Zn2+可与H2O之间形成 [Zn(H2O)6]2+,其中提供空轨道的是______________(填微粒符号)。
(3)碳酸乙烯酯中碳原子杂化轨道类型为________;1mol碳酸乙烯酯中含有的σ键数目为________。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
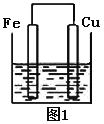
【题目】将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,铜片周围溶液会出现___________的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,计算:导线中流过的电子的物质的量为_________________mo1;
(3)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
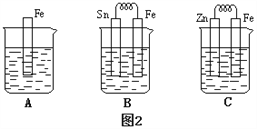
①图2 B中的Sn为________极,Sn极附近溶液的pH(填增大、减小或不变)___________。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(4)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
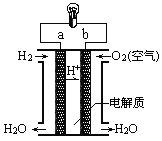
①氢氧燃料电池的总反应化学方程式是:___________________。
②电池工作一段时间后硫酸溶液的浓度_____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com