
����Ŀ����֪�ⶨ�к��ȵ�ʵ�鲽�����£�
����ȡ50mL 0.25mol/L���ᵹ��С�ձ��У������¶ȣ�
����ȡ50mL 0.55mol/L NaOH��Һ�������¶ȣ�
�۽�NaOH��Һ����С�ձ��У���Ͼ��Ⱥ�������Һ�¶ȣ�
��ش�
��1��NaOH��Һ�Թ�����ԭ�� ��
��2������NaOH��Һ����ȷ������__________������ĸ����
A.�ز�������������
B.һ��Ѹ�ټ���
C.�������
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������ ��
��4������Һ���ܶȾ�Ϊ1gcm��3 �� �кͺ���Һ�ı�����c=4.18J��g�棩��1 �� �����ʵ����������к���Ϊ ��д���÷�Ӧ���Ȼ�ѧ����ʽ ��
�¶� | ��ʼ�¶�t1/�� | ��ֹ�¶� | �¶Ȳ�ƽ��ֵ | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
��5��������0.5mol H2SO4��Ũ�����뺬1mol NaOH����Һ��ϣ��ų����������С�ڡ��������ڡ����ڡ���57.3kJ��ԭ���� ��
���𰸡�
��1��ȷ�����ᱻ��ȫ�к�
��2��B
��3���������¶ȼ��ϵĻ��β������������ؽ���
��4��56.85kJ/mol��H2SO4��aq��+2NaOH��aq��=Na2SO4��aq��+2H2O��H=��113.7kJ/mol
��5�����ڣ�Ũ��������ˮ�ų�����
����������1��ʵ���У�����NaOH�Թ�����ԭ����ȷ�����ᷴӦ��ȫ����2����������������Һʱ������һ��Ѹ�ٵĵ��룬Ŀ���Ǽ���������ɢʧ�����ּܷ��ε�������������Һ������ᵼ������ɢʧ��Ӱ��ⶨ����� ��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ���������ǣ��������¶ȼ��ϵĻ��β������������ؽ�������4��50mL 0.25mol/L������50mL 0.55mol/L NaOH��Һ�����кͷ�Ӧ����ˮ�����ʵ���Ϊ0.05L��0.25mol/L��2=0.025mol����Һ������Ϊ100ml��1g/ml=100g���¶ȱ仯��ֵΪ����ʵ���ƽ��ֵ3.4�棬������0.025molˮ�ų�������ΪQ=mc��T=100g��4.18J/��g�棩��3.4��=1421.2J����1.421kJ��
����ʵ���õ��к��ȡ�H=��![]() =��56.85kJ/mol���÷�Ӧ���Ȼ�ѧ����ʽH2SO4��aq��+2NaOH��aq��=Na2SO4��aq��+2H2O��H=��113.7kJ/mol����5��Ũ��������ˮ�ų����������Ժ�0.5mol H2SO4��Ũ�����뺬1mol NaOH����Һ��ϣ��ų�����������57.3kJ��
=��56.85kJ/mol���÷�Ӧ���Ȼ�ѧ����ʽH2SO4��aq��+2NaOH��aq��=Na2SO4��aq��+2H2O��H=��113.7kJ/mol����5��Ũ��������ˮ�ų����������Ժ�0.5mol H2SO4��Ũ�����뺬1mol NaOH����Һ��ϣ��ų�����������57.3kJ��
�����㾫����������Ĺؼ����������к��ȵ����֪ʶ��������ϡ��Һ�У���ͼ���кͷ�Ӧ������1mol H2O����ʱ�ķ�Ӧ�Ƚ����к��ȣ�


 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ��Ա���Ϊ��Ҫ��ʼԭ�ϣ�ij��ҩ���м���ĺϳ�·����ͼ�� 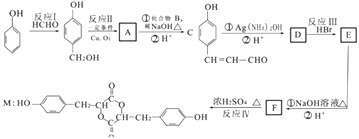
��֪�� ![]()
�ڱ��ⲻ���Ƿ��ǻ���������Һ���кͷ�Ӧ
��1��C�к��������ŵ�����Ϊ�������� B��������
��2�������ϳ�·�������ڼӳɷ�Ӧ��������
��3��д�����л�ѧ����ʽ
C��������Һ��Ӧ
��4���������������� F��ͬ���칹��Ľṹ��ʽ���֣�
�ٱ�����������ȡ�����ұ����ϵ�һ��ȡ����ֻ�����֣�
������FeCl3��Һ������ɫ��Ӧ��
�ۺ��������ʾ�� HCOO���ṹ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���ƺ�̼�������������г��������ʣ���ش��������⣮
��1��̼�������׳� �� ��ˮ��Һ���ԣ�����ᡱ��������С�����
��2��̼�����ƿ�����θ�ᣨ0.2%��0.4%�����ᣩ���࣬��Ӧ�����ӷ���ʽΪ ��
�����ʵ�����̼���ƺ�̼�����Ʒֱ����������ᷴӦʱ����CO2������ǰ�����ߣ����������������=������
��3����ȥ̼���ƹ�����̼�����Ƶķ�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ���ǣ�������
A.��Ӧ��������������������������ʱ���÷�Ӧ�ڳ�����һ�����ܷ���
B.��֪C��s��+CO2��g���T2CO��g������H1��C��s��+ ![]() O2��g���TCO��g������H2 �� ���H1����H2
O2��g���TCO��g������H2 �� ���H1����H2
C.��֪��2SO2��g��+O2��g�� =2SO3��g������H=��98.3kJ/mol����1mol SO2��0.5molO2����һ�ܱ������з�Ӧ���ų�49.15kJ������
D.��ʯī�Ƚ��ʯ�ȶ���֪��C�����ʯ��s��=C��ʯī��s������H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̫���ֽܷ�ˮ���⣬�����0.02molˮ������˵����ȷ���ǣ� ��
A.������H2������Ϊ0.02g
B.���������ԭ����Ϊ2.408��1023��
C.������H2�����Ϊ0.224L���������
D.����H2���������ϵ���0.04mol Na��ˮ��Ӧ����H2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ʯī��һ��������ת���ɽ��ʯ�����ȷ�Ӧ���ɴ˿��ܳ�����ȷ������
A. ʯī�Ƚ��ʯ���ȶ�B. ���ʯ��ʯī���ȶ�
C. ʯīת���ɽ��ʯ�������仯D. ʯī�ͽ��ʯ�Ľṹ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԭ���װ��ʾ��ͼ��
��1����AΪZn��BΪʯī�����������ҺΪϡ���ᣬд�������ĵ缫��Ӧʽ ��
��2����AΪͭƬ��BΪ��Ƭ�������ΪFeCl3��Һ������ͭƬΪ������������д���õ缫��Ӧʽ�� ��
��3����A��B��Ϊ��Ƭ�������ΪKOH��Һ���ֱ��A��B����ͨ��H2��O2 �� �õ�ؼ�Ϊȼ�ϵ�أ�ͨ��������һ��Ϊ�õ�ص��������������õ�صĸ�����ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuCl�㷺Ӧ���ڻ�����ӡȾ����ҵ��ij�о���ѧϰС�����ȷֽ�CuCl22H2O�Ʊ�CuCl�����������̽����
�����ϲ��ġ�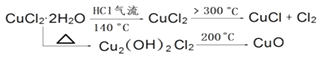
��ʵ��̽������С������ͼ��ʾװ�ý���ʵ�飨�г������ԣ���
��ش��������⣺
��1������X�������� ��
��2��ʵ��������Ⱥ�˳����a����e��������ı�ţ�
a�����װ�õ������Ժ����ҩƷ b��Ϩ��ƾ��ƣ���ȴ
c���ڡ�������ڡ�������HCl d����ȼ�ƾ��ƣ�����
e��ֹͣͨ��HCl��Ȼ��ͨ��N2
��3����ʵ������У��۲쵽B�������ɰ�ɫ��Ϊ��ɫ��C����ֽ����ɫ�仯�� ��
��4��װ��D�з�����������ԭ��Ӧ�����ӷ���ʽ�� ��
��5����Ӧ������ȡ��CuCl��Ʒ����ʵ�飬�������к���������CuCl2��CuO���ʣ�����������Ϣ����������������CuCl2 �� �������ԭ���� ��
����������CuO���������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������Wԭ�ӵ����������������ڲ��������3���������ж���ȷ���ǣ� �� 
A.ԭ�Ӱ뾶��W��Z��Y��X
B.��YԪ�ص�����Һһ��������
C.�����̬�⻯������ȶ��ԣ�Z��W
D.X����Ԫ����ɵĻ�����XH5��ˮ��Ӧ�ɲ�����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com