
| A. | 溶液中只有离子,没有溶质分子 | |
| B. | 溶液中只有溶质分子,没有离子 | |
| C. | 在弱电解质的电离方程式中,可用“═”表示 | |
| D. | 溶液中分子和离子同时存在 |
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27.5 g•mol-1 | B. | 55 g•mol-1 | C. | 100 g•mol-1 | D. | 111 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质.
如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
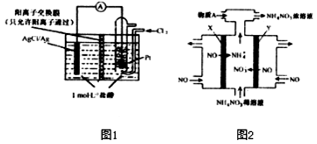 氧化还原反应与生产、生活、科技密切相关,请回答下列问题:
氧化还原反应与生产、生活、科技密切相关,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
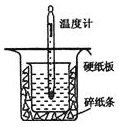 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 0.3 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com