
【题目】元素化合物在日常生活、化工生产和环境科学中有着重要的用途。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________。
(2)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将Cr2O72-还原。写出反应的离子方程式:___________________________________________。
(3)当皮肤划破时可用FeCl3溶液应急止血,其主要作用是__________________。
(4)高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式Fe(OH)3+ C1O-+ OH-→ FeO42-+ C1-+ H2O(未配平),Fe(OH)3与 C1O-的计量数比为:__________,每生成1mol K2FeO4,转移的电子数是_________。
(5)合成氨及其相关工业中,部分物质间的转化关系如下:

反应IV属于___________反应类型,氮肥主要成分的化学式为_______________,V的化学反应方程式为_________________。
【答案】Fe2+、Fe3+、H+ Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O FeCl3溶液促进血液胶体聚沉 2:3 3NA或1.806×1024 氧化还原反应 NH4NO3 NH3+ H2O+ CO2+ NaCl ═ NaHCO3↓+ NH4Cl
【解析】
(1)X在足量的空气中高温煅烧,生成有磁性物质四氧化三铁,其与过量盐酸反应生成氯化铁和氯化亚铁;
(2)亚硫酸钠具有还原性,能够在酸性条件下将Cr2O72-还原为Cr3+,据此写出反应的离子方程式;
(3)血液属于胶体,遇到电解质溶液发生聚沉;
(4)根据电子得失守恒、电荷守恒和原子守恒配平离子方程式,根据电子转移关系进行计算。
(5) N2和H2可以合成NH3,所以甲是N2,氨气和二氧化碳通入氯化钠溶液可以析出溶解度较小的碳酸氢钠晶体,加热分解可以得到碳酸钠纯碱;氨气和氧气反应,催化氧化得到NO,NO遇到氧气变为二氧化氮,二氧化氮和水之间反应生成硝酸,硝酸和氨气之间反应得到硝酸铵,属于一种氮肥,所以乙是NO,丙是NO2,丁是NaHCO3,据此回答。
(1)X在足量的空气中高温煅烧,生成有磁性的固体Y,Y为四氧化三铁,与过量盐酸反应生成氯化铁和氯化亚铁,Y溶于过量盐酸后溶液中大量存在的阳离子是Fe2+、Fe3+、H+;
因此,本题正确答案是:Fe2+、Fe3+、H+;
(2)亚硫酸钠具有还原性,能够在酸性条件下将Cr2O72-还原为Cr3+,反应的离子方程式为Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O;
因此,本题正确答案是:Cr2O72-+3SO32-+8H+═2Cr3++3SO42-+4H2O;
(3)血液属于胶体,FeCl3溶液属于电解质溶液,它能使胶体发生聚沉,起到应急止血作用;
因此,本题正确答案是:FeCl3溶液促进血液胶体聚沉;
(4)Fe(OH)3→FeO42-,铁元素由+3价升高到+6价,变化了3价,ClO-→Cl-,氯元素由+1价降到了-1价,变化了2价,根据化合价升降总数相等原则,所以Fe(OH)3填系数2,ClO-填系数3,。再根据电荷守恒、原子守恒配平其它物质,该反应的离子方程式为2Fe(OH)3+ 3C1O-+ 4OH-=2FeO42-+3C1-+ 5H2O,Fe(OH)3与 C1O-的计量数比为:2:3;通过反应关系:6e-~2 FeO42-可知,每生成1mol K2FeO4,转移的电子数是3NA或1.806×1024;
因此,本题正确答案是:2:3;3NA或1.806×1024;
(5)氮气和氢气可以合成氨,所以甲是氮气,氨气和二氧化碳通入氯化钠溶液可以析出溶解度较小的碳酸氢钠晶体,加热分解可以得到碳酸钠纯碱;氨气和氧气反应,催化氧化得到NO,NO遇到氧气变为二氧化氮,二氧化氮和水之间反应生成硝酸,硝酸和氨气之间反应得到硝酸铵,属于一种氮肥,所以乙是NO,丙是NO2,丁是NaHCO3,反应IV为NO2和水反应生成硝酸和NO,属于氧化还原反应;硝酸和氨气反应生成硝酸铵,所以氮肥主要成分的化学式为NH4NO3;反应V是侯氏制碱法,化学方程式为NH3+ H2O+ CO2+ NaCl ═ NaHCO3↓+ NH4Cl;
因此,本题正确答案是:NH3+ H2O+ CO2+ NaCl ═ NaHCO3↓+ NH4Cl。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下表各组物质中,物质间不可能实现如图![]() 转化的是( )
转化的是( )
选项 | X | Y | Z | M |
A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
C | NH3(g) | NO | NO2 | O2 |
D | NaOH | NaAlO2 | Al(OH)3 | AlCl3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个体积可变的密闭容器中充入2 mol的气体A和1 mol的气体B发生反应:2A(g)+B(g)![]() 3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )
3C(g) ΔH>0。t1时刻反应达到平衡,并测得C在容器中的体积分数为φ1。t2时刻改变某一条件(其他条件不变),C在容器中的体积分数的变化如图所示,则t2时刻改变的条件是( )

A. 加入1 mol氦气
B. 加入1 mol B
C. 增大压强
D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示。请回答下列问题:

(1)装置B的作用是________________。
(2)装置C中发生反应的离子方程式是_____________________________。
SO2在装置D中完全转化为酸式酸根离子的过程中,溶液颜色变化是________。
(3)已知酸性:HCl>H2SO3>HClO。向Na2SO3溶液中加入盐酸酸化的NaClO溶液时,证明NaClO不足时的试剂是________。
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka大于其水解平衡常数Kh。______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)检查装置 A 的气密性方法是:_____。
(2)装置 B 中饱和食盐水的作用是_____;同时装置 B 亦是安全瓶,监测实验进行时 C中是否发生堵塞,请写出发生堵塞时 B 中的现象_____。
(3)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入_____。
A | B | C | D | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,观察到的现象是_____,该现 象_____(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所涉及的物质均为常见物质,其中A、B、C为单质,其余为化合物;B为金属。它们存在如下转化关系(反应中其它产物已略去,有的反应在溶液中进行)。

(1)写出B的化学式_____。
(2)C在A中燃烧的现象是_____,反应类型是_____。
(3)写出反应①的化学方程式_____。
(4)写出F→E反应的离子方程式_____。
(5)写出工业上以A和石灰乳为原料制造漂白粉的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了如图装置制取和验证SO2的性质。
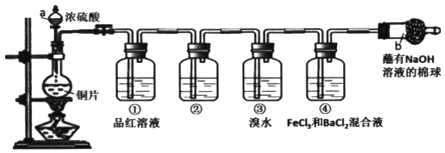
请回答:
(1)写出图中仪器的名称:a________,b________。
(2)棉球中NaOH溶液的作用是________。
(3)为了验证SO2是酸性氧化物,洗气瓶②中可选择的试剂是_______。
A 紫色石蕊试液 B 无色酚酞试液 C 澄清石灰水 D 碘水
(4)下列说法正确的是_______。
A 实验开始时,只需打开分液漏斗的旋塞,即可使液体顺利滴下
B 先向装置中加入试剂(药品),再进行气密性检查
C 实验开始后,洗气瓶①和③中溶液均褪色,两者均可证明SO2具有漂白性
D 实验开始后,洗气瓶④中可观察到白色沉淀产生,该现象可说明SO2具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种元素组成的矿物A,测定A的组成流程如下:

请回答:
(1)②反应中除了产生D外,还有一种气体生成,请写出该气体的电子式____________
(2)写出①的化学方程式:_______________________________________________________
(3)写出③的离子方程式:____________________________________________________
(4)检验E溶液中含有Fe2+ 的方法是:_____________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com