
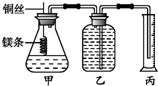
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:分析 步骤②量取10.0 1.0mol•L的盐酸溶液加入锥形瓶中,量筒精确到0.1,故选用10mL量筒即可;
根据氯化氢的物质的量及化学方程式计算镁条的质量;
(1)根据压力差检验装置的气密性;
(2)Mg+2HCl═MgCl2+H2↑产生的氢气的体积即为排出的水的体积,据此选择量筒的规格;
(3)根据气体摩尔体积的计算式,Vm=$\frac{V}{n}$计算即可.
解答 解:量筒精确到0.1,题中要求酸的体积10.0mL,故选用10mL量筒即可;
步骤③
Mg+2HCl═MgCl2+H2↑
1mol 2mol
n 0.01 mol
n=0.005mol 故a=24g/mol×0.005mol=0.12g.
故答案为:10 mL量筒;0.12;
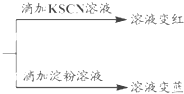
(1)根据压力差检验装置的气密性,两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好,
故答案为:两手掌紧贴锥形瓶外壁一会儿,如果观察到广口瓶中长导管内有一段水柱高出液面,表明装置气密性良好;
(2)根据反应Mg+2HCl═MgCl2+H2↑可知0.01 molHCl,产生的氢气的体积为112mL,即为排出的水的体积O 112mL,所以要选择量筒的规格为200mL,
故选B,读数时除恢复到室温外,还要注意量筒内的液面与集气瓶内的液面相平,
故答案为:B;量筒内的液面与集气瓶内的液面相平;
(3)0.01mol氯化氢完全反应能够生成0.005mol氢气,该氢气的体积为VmL,若忽略水蒸气的影响,则在该实验条件下测得气体摩尔体积的计算式为:Vm=$\frac{V}{n}$=0.2V L•mol-1;
若未除去镁条表面的氧化膜,导致生成的氢气体积减少,则测量结果偏小,
故答案为:0.2V L•mol-1;偏小.
点评 本题主要考查常温下气体摩尔体积的测定,题目难度中等,明确实验目的及化学实验基本操作方法为解答关键,注意掌握气体摩尔体积的概念及计算方法,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 金属原子最外层电子的个数 | |
| B. | 1 mol金属与酸反应放出氢气的多少 | |
| C. | 1 mol金属失去电子的多少 | |
| D. | 金属原子失去电子的难易程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的摩尔质量为16g | |
| B. | 标准状况下,18 g H2O的体积是22.4 L | |
| C. | 17 g NH3的物质的量是1 mol | |
| D. | 阿伏加德罗常数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用“84消毒液”进行消毒 | |
| B. | 用浓硫酸干燥二氧化硫气体 | |
| C. | 用活性炭吸附新装修居室里的有害气体 | |
| D. | 用小苏打治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
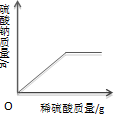 | 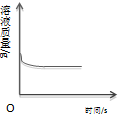 |  | 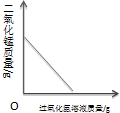 |
| A.向一定质量的氢氧化钠溶液中加入稀硫酸至过量 | B.向一定质量的稀硫酸中加入锌片 | C.加热一定质量的高锰酸钾固体 | D.向一定质量的二氧化锰中加入过氧化氢溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
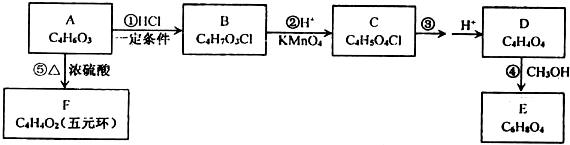
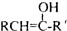 (R和 R′,代表烷基或 H)不稳定,本题各物质均不考虑此类结构.
(R和 R′,代表烷基或 H)不稳定,本题各物质均不考虑此类结构. 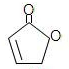 E(反式):
E(反式):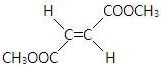
 .
.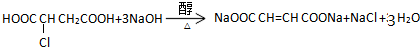 .
. .
.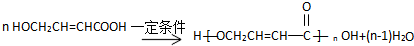 .
.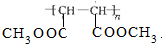 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
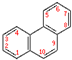 .它的一氯代物有5种.
.它的一氯代物有5种.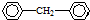 ,试再写出另一种的结构简式
,试再写出另一种的结构简式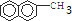 .
.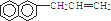 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com