“氢能”将是未来最理想的新能源.
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
.(填序号)
A.2H
2(g)+O
2(g)=2H
2O(l);△H=-142.9kJ?mol
-1B.H
2(g)+
O
2(g)=H
2O(l);△H=-285.8kJ?mol
-1C.2H
2+O
2=2H
2O(l);△H=-571.6kJ?mol
-1D.H
2(g)+
O
2(g)=H
2O(g);△H=-285.8kJ?mol
-1(2)某化学家根据“原子经济”的思想,设计了如下制备H
2的反应步骤
①CaBr
2+H
2O
CaO+2HBr
②2HBr+Hg
HgBr
2+H
2③HgBr
2+
④2HgO
2Hg+O
2↑
⑤2H
2+O
22H
2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式:
.并根据“绿色化学”的思想评估该方法制H
2的主要缺点:
.
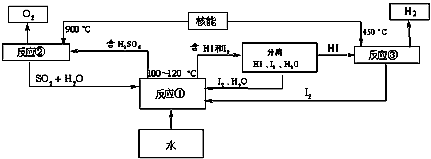
(3)利用核能把水分解制氢气,是目前正在研究的课题.如图1是其中的一种流程,其中用了过量的碘.
完成下列反应的化学方程式:反应①
;反应②
.此法制取氢气的最大优点是
.
(4)目前有科学家在一定条件下利用水煤气(CO+H
2)合成甲醇:
CO(g)+2H
2(g)
CH
3OH(g).甲醇的物质的量与反应温度的关系如图2所示:
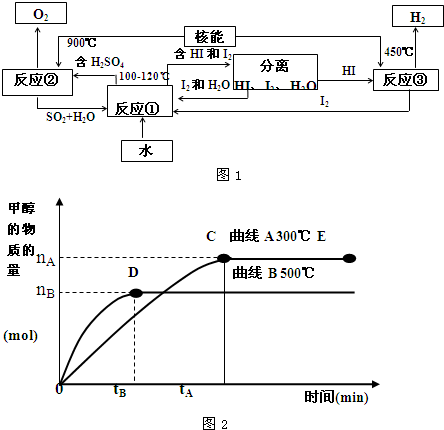
①合成甲醇反应,其反应热△H
0.(填“>”、“<”或“=”)
②其它条件不变,对处于E点的体系体积压缩到原来的
,正反应速率加快,逆反应速率
.(填“加快”、“减慢”、“不变”)重新平衡时
.(填“增大”、“减小”或“不变”)
③据研究,合成甲醇反应体系中通入少量CO
2有利于维持催化剂Cu
2O的量不变,原因是(用化学方程式表示)
.




 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg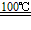 HgBr2+H2
HgBr2+H2  HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑