
【题目】向50mLNa2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g,并有气体产生。
(1)原混合溶液中Na2SO4的物质的量浓度是______________。
(2)产生的气体在标准状况下的体积是______________。
(3)原溶液中Na+物质的量浓度是______________。
【答案】
(1)0.4mol/L;(2)1.12L(3)2.8 mol/L;
【解析】
试题分析:(1)14.51克白色沉淀是BaCO3和BaSO4混合物,加入过量的稀HNO3,充分反应后,剩余沉淀4.66g为BaSO4,BaSO4的物质的量为![]() =0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为
=0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为![]() =0.4mol/L,故答案为:0.4mol/L;
=0.4mol/L,故答案为:0.4mol/L;
(2)减少的沉淀质量为BaCO3,故BaCO3的质量为14.51g-4.66g=9.85g,物质的量为![]() =0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.05mol,故生成的二氧化碳的体积为0.05mol×22.4L/mol=1.12L,故答案为:1.12L;
=0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.05mol,故生成的二氧化碳的体积为0.05mol×22.4L/mol=1.12L,故答案为:1.12L;
(3)原溶液中Na+物质的量= 2n(Na2SO4)+ 2n(Na2CO3)=2×0.02mol+2×0.05mol=0.14mol,Na+物质的量浓度=![]() =2.8 mol/L,故答案为:2.8 mol/L。
=2.8 mol/L,故答案为:2.8 mol/L。


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.物质的量是用来研究微观粒子的一个国际基本物理量,其单位是摩尔
B.气体的摩尔体积与温度和压强有关,压强越大,体积越大
C.若x个N (氮)原子的质量是1 g,则阿伏加德罗常数可表示为14 x mol-1
D.任何一种微观粒子,当摩尔质量以gmol-1为单位时,其数值与这种粒子的相对分子质量或相对原子质量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12g铁粉加入25mL 2molL﹣1的氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl﹣浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
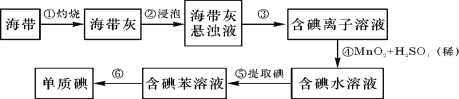
(1)从上述步骤中可知,海带中含有的碘元素的主要存在形式是 (填化学式)。
(2)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A烧杯 B表面皿 C坩埚 D酒精灯 E干燥器
(3)步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指列实验装置中的错误之处。
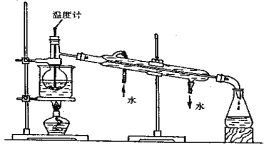
① ;② ;③ ;
进行上述蒸馏操作时,使用水浴的原因是 ;最后晶态碘在 里聚集。
(4)步骤④反应的离子方程式是 。若用碘盐中的KIO3作氧化剂,在酸性溶液中氧化I—,写出反应的离子方程式 。
(5)检验海带中是否含有碘元素,可以在步骤④后进行,检验时可用的试剂是 。
(6)步骤⑤中,某学生选择用苯来提取碘,其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将分液漏斗上口倒出上层溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。
就此实验,完成下列填空:
正确操作步骤的顺序是 → → →A→G→ →E→F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据有机化合物的命名原则,下列命名正确的是( )
A.![]() 3-甲基-1,3-丁二烯
3-甲基-1,3-丁二烯
B.![]() 2-羟基丁烷
2-羟基丁烷
C.CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷
D.CH3CH(NH2)CH2COOH 3-氨基丁酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将________(填“增大”、“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1 000 |
c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
则500 s内N2O5的分解速率为__________。
③在T2温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2________T1。
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的________区生成,其电极反应式为____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是( )
A. 常温常压下,8 g O2含有4NA个电子
B. 盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
C. 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为2NA
D. 标准状况下,22.4 L的NO2和CO2混合气体含有2NA个O原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com