
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:2014-2015学年安徽省高二上学期期中化学试卷(解析版) 题型:选择题
草药莪术根茎中含有一种色素,它的结构简式为CH2-(CO-CH=CH- -OH)2用它制成的试纸可以检验溶液的酸碱性。能够跟1 mol该化合物起反应的Br2水溶液或H2的最大用量分别是
-OH)2用它制成的试纸可以检验溶液的酸碱性。能够跟1 mol该化合物起反应的Br2水溶液或H2的最大用量分别是
A.3 mol 3 mol B.3 mol 5 mol
C.6 mol 6 mol D.6 mol 10 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省高一上学期期末考试化学试卷(解析版) 题型:选择题
通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
A.硝酸钠 氢氧化钠 B.氧化铜 二氧化锰
C.氯化钾 碳酸钙 D.硫酸铜 氢氧化钠
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高一上学期期末化学试卷(解析版) 题型:选择题
下列物质组合中,既能和酸反应又能和碱反应的化合物是
①Al ②Al2O3 ③Al(OH)3 ④NaHCO3
A.①②③④ B.②③④ C.①③④ D.①②④
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:填空题
(16分)Ⅰ.用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:_____________________________
(2)有关数据记录如下:
滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.55 |
2 | 20.00 | 6.00 | 25.95 |
纯度计算:烧碱样品的纯度为________________。
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱溶液的浓度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果________。
Ⅱ.现有室温下浓度均为1×10-3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④NaOH溶液,回答下列问题:
(1)将③、④混合后,若溶液呈中性,则消耗两溶液的体积为③________④(填“>”、“<”或“=”)。溶液中的离子浓度由大到小的顺序为________________。
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为___________,(填序号)最终产生H2总量的关系为___________(填序号)
(3)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①_________③(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀
C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第三次月考化学试卷(解析版) 题型:实验题
(10分)为测定某含有杂质Na2O的Na2O2样品的纯度,2个小组分别设计如下方案。首先准确称量样品mg,然后,按照以下方案进行实验,请你完成相关内容:
[方案一]:将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量。
(1)Na2O2跟水反应的离子方程式是: ;
(2)根据所给数据计算出的试样中Na2O2含量的代数式为 。
[方案二]:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。

(1)上图是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是 。(填写仪器编号)
(2)装置①⑤的作用分别是:① ⑤ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:填空题
(10分)工业上利用电解污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:
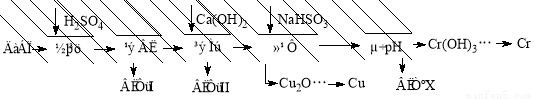
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有 。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH范围为: ~ ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com