
对于反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH <0,在其他条件不变的情况下( )
CO2(g)+H2(g) ΔH <0,在其他条件不变的情况下( )
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
将0.4molMg、Al的混合物用盐酸完全溶解,放出标况下11.2L气体,然后再投入一定量Na2O2固体,若该混合物与盐酸恰好完全反应,欲使最终沉淀为纯净物,则所加入Na2O2固体的质量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
中国人民银行定于2011年4月15日发行中国京剧脸谱彩色金银纪念币,其中银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为银纪念币制作时,铜芯应做
A.阴极 B.阳极 C.正极 D.负极
查看答案和解析>>
科目:高中化学 来源: 题型:
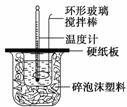 某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和。试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热____________(填“偏大”、“偏小”或“不变”)。
(2)在中和热测定实验中存在用水洗涤温度计上的盐酸的步骤,若无此操作步骤,则测得的中和热会____________(填“偏大”、“偏小”或“不变”)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会____________(填“偏大”、“偏小”或“不变”),其原因是_______________________________________________。
(4)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则该反应的中和热为ΔH=______ __。根据计算结果,写出该中和反应的热化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的四份溶液:①0.01mol·L-1 CH3COOH;②0.01mol·L-1 HCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是( )
A. ①中水的电离程度最小,③中水的电离程度最大
B. 将②③混合,若有pH=7,则消耗溶液的体积:②>③
C. 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
D. 将①④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+ PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D.P—P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是
A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴
查看答案和解析>>
科目:高中化学 来源: 题型:
草酸(H2C2O4)是一种重要的有机化工原料。为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如下图所示
①一定量的淀粉水解液加入三颈烧瓶中

②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2︰1.25)
③反应3小时,冷却,抽滤后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:
C6H12O6+12HNO3 3H2C2O4+9NO2↑+3NO↑+9H2O
3H2C2O4+9NO2↑+3NO↑+9H2O
(1)上图实验装置中仪器乙的名称为:________________________。
装置B的作用是 。
(2)检验淀粉是否水解完全的方法:______________________________________________。[
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(3)向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:____________________________________________________。
(4)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快。为探究其原因,同学们做了如下对比实验;

由此你认为溶液褪色总是先慢后快的原因是_________________________________________。
(5)草酸亚铁在工业中有重要作用,草酸可以制备草酸亚铁,步骤如下:
称取FeSO4·7H2O 固体于小烧杯中,加入水和少量稀H2SO4溶液酸化,加热溶解。向此溶液中加入一定量的H2C2O4溶液,将混合溶液加热至沸,不断搅拌,以免暴沸,待有黄色沉淀析出并沉淀后,静置。倾出上清液,再加入少量水,并加热,过滤,充分洗涤沉淀,过滤,用丙酮洗涤固体两次并晾干。
①生成的草酸亚铁需充分洗涤沉淀,检验是否洗涤完全的方法是 。
②用丙酮洗涤固体两次的目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com