
(10分) Ⅰ 硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:
S2--2e-===S (n-1)S+S2-===S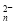

①写出电解时阴极的电极反应式:________________。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成__________________________。
Ⅱ. 用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
FeCl3与H2S反应的离子方程式为________________________________________________。
电解池中H+在阴极放电产生H2,阳极的电极反应为___________________________________。
综合分析的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;② 。
(10分)I(1)①2H2O+2e-==H2↑+2OH- ②Sx2-+2H+= (x-1)S↓+H2S↑
II 2Fe3++ H2S=2Fe2++ S↓+2H+;Fe2+-e-= Fe3+;FeCl3得到循环利用。
【解析】
试题分析:I(1)①烧碱吸收硫化氢得到的溶液是Na2Sx溶液,所以阴极是阳离子放电,则阴极反应是氢离子放电生成氢气,电解反应式为2H2O+2e-==H2↑+2OH- ;
②电解后阳极区离子为Sx2-,酸性条件下,Sx2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素与氢离子结合生成H2S,反应方程式为Sx2-+2H+=(x-1)S↓+H2S↑;
II FeCl3与H2S发生氧化还原反应,生成亚铁离子、S单质,反应的离子方程式为2Fe3++ H2S=2Fe2++ S↓+2H+;电解池中H+在阴极放电产生H2,则阳极是亚铁离子放电生成铁离子,阳极的电极反应为Fe2+-e-= Fe3+;结合以上两个反应,可知实验有两个显著优点:H2S的原子利用率100%;FeCl3得到循环利用。
考点:考查电解反应原理的分析,电极反应式的书写


科目:高中化学 来源:2014-2015安徽省高二上学期第一次质量检测化学试卷(解析版) 题型:填空题
(10分)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

(1)铁钉在逐渐生绣。
(2)若试管内液面上升,发生 腐蚀,电极反应:负极: ,正极: 。
(3)若试管内液面下降,则原溶液呈 性,发生的电极反应:正极: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高二上学期期中化学试卷(解析版) 题型:选择题
常温下用pH试纸测定某溶液的pH,如果将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,测得pH=6。则此溶液的实际pH
A.大于6 B.小于6 C.等于6 D.大于7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高一上学期期中化学试卷(解析版) 题型:选择题
下列关于Fe(OH)3胶体的制备,正确的操作是
A.将FeCl3 溶液滴入蒸馏水中即可
B.将FeCl3 溶液滴入热水中,得到黄色液体即可
C.将FeCl3 溶液滴入沸水中,得到红褐色液体即可
D.将FeCl3 溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高一上学期期中化学试卷(解析版) 题型:选择题
将1mol NaOH溶于水中,配制成1 L溶液,则该溶液的物质的量浓度为
A.0.1 mol/L B.0.5 mol/L C.4 mol/L D.1 mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A.向水中投入一小块金属钠
B.将水加热煮沸
C.向水中通入二氧化碳气体
D.向水中加食盐晶体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.用锡焊接的铁质器件,焊接处易生锈
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁?过氧化氢燃料电池系统。其工作原理如图所示。以下说法中错误的是
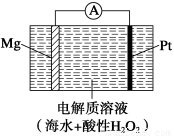
A.电池的负极反应为Mg-2e-===Mg2+
B.电池工作时,H+向负极移动
C.电池工作一段时间后,溶液的pH增大
D.电池总反应式是Mg+H2O2+2H+===Mg2++2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:选择题
(12分) 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。

①能说明该反应已达平衡状态的是________
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1, 且保持不变
②下列措施中能使 增大的是________ (选填编号)。
增大的是________ (选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=___________ , 若改变条件 (填选项),可使K=1。
A增大压强 B增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
 (2)某甲醇燃料电池原理如图1所示:M区发生反应的电极反应式为_______________________________。
(2)某甲醇燃料电池原理如图1所示:M区发生反应的电极反应式为_______________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com