
下列关于电解原理的叙述正确的是 ( )
A.为防止轮船腐蚀,将轮船的外壳与外电源的负极相连
B.在锌片上镀铜,用氯化锌溶液作电镀液
C.电解氯化钠溶液制备氢气和氯气时,用铁作阳极
D.用电解法精炼铜时,在阴极上可析出铁
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
利用NO2平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程。
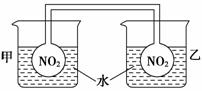
①按图所示将实验装置连接好。
②向甲烧杯的水中投入一定量的CaO固体,此烧杯中的NO2平衡混合气体的红棕色变深;向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体颜色变浅。
回答下列问题:
(1)CaO与水反应的化学方程式为______________________________,该反应为________(填“吸热反应”或“放热反应”)。
(2)NH4NO3晶体溶于水温度________(填“升高”或“降低”)。NH4NO3溶于水________(填“是”或“不是”)吸热反应。
(3)查阅资料知NO2的平衡气体中存在的可逆反应为2NO2(g) 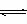 N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”、“减小”或“不变化”)。混合气体的颜色不变______(填“能”或“不能”)证明反应已达平衡。
N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”、“减小”或“不变化”)。混合气体的颜色不变______(填“能”或“不能”)证明反应已达平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外活动小组设计了如图所示装置,调节滑动变阻器,在电流强度适中的情况下用其进行缓慢电解NaCl溶液及相关实验(此时,打开止水夹a,关闭止水夹b)。由于粗心,实验并未达到预期目的,但也看到了令人高兴的现象。请帮助他们分析并回答下列问题(图中阳离子交换膜只允许阳离子和水分子通过):
(1)写出B装置中的电极反应式:
Pt极____________________________________________________________________;
Fe极____________________________________________________________________。
(2)写出观察到的A装置中的现象:
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b,再观察C装置。若无现象,说明理由;若有现象,请写出有关反应方程式__________________________
________________________________________________________________________。
(4)若想达到电解NaCl溶液的目的,应如何改进装置,请提出你的意见________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
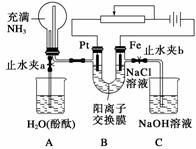
 如图装置中,小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是 ( )
如图装置中,小试管内为红墨水,具支试管内盛有pH=4久置的雨水和生铁片。实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面。下列说法正确的是 ( )
A.生铁片中的碳是原电池的阳极,发生还原反应
B.雨水酸性较强,生铁片仅发生析氢腐蚀
C.墨水回升时,碳电极反应式为O2+2H2O+4e-===4OH-
D.具支试管中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是 ( )
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.铁管上镶嵌锌块,铁管不易被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解下列溶液一小段时间后,加入一定量的另一种物质(括号内),溶液能与原来溶液完全一样的是 ( )
A.CuSO4[Cu(OH)2] B.NaOH(NaOH)
C.NaCl(NaCl) D.CuCl2(CuCl2)
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
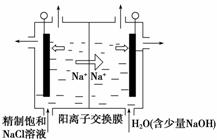
①图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为_____________________________________________________________
________________________________________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________ mol;用平衡移动原理解释阴极区pH增大的原因:_____________________________________________________________________
________________________________________________________________________。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为_________________________________________________
________________________________________________________________________。
若以该电池为电源,用石墨作电极电解100 mL含有如下离子的溶液。
| 离子 | Cu2+ | H+ | Cl- | SO |
| c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为________ mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是通电后将 Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用右 图装置模拟上述过程:
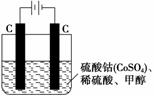
①写出阳极电极反应式:_________________________________________________。
②除去甲醇的离子反应为6Co3++CH3OH+H2O===CO2↑+6Co2++6H+,该过程中被氧化的元素是__________,当产生标准状况下2.24 L CO2时,共转移电子________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的结构简式为
Embed ChemDraw.Document.6.0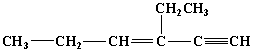 ,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
,分子中含有四面体结构的碳原子数为a,在同一条直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别是( )
A. 4、4、5 B. 2、5、4 C. 4、3、6 D. 4、6、4
查看答案和解析>>
科目:高中化学 来源: 题型:
LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
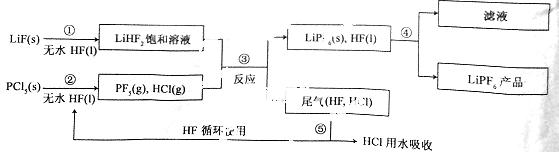
已知:HCl的沸点是-85.0 ℃,HF的沸点是19.5 ℃。
(1)第①步反应中无水HF的作用是 、 。反应设备不能用玻璃材质的原因是 (用化学方程式表示)。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的 溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PCl5极易水解,其产物为两种酸,写出PCl5水解的化学方程式: 。
(3)第④步分离采用的方法是 ;第⑤步分离尾气中HF、HCl采用的方法是 。
(4)LiPF6产品中通常混有少量LiF。取样品wg。测得Li的物质的量为nmol,则该样品中LiPF6的物质的量为 mol(用含有w、n的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com