
苹果酸(HOOCCHOHCH2COOH)是重要的食品添加剂,有多种同分异构体,其中与苹果酸的官能团相同,官能团的个数也相同的有(不考虑立体异构)
A.2种 B.3种 C.4种 D.5种
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年吉林省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.每一周期元素都是从碱金属开始,以稀有气体结束
B.f区都是副族元素,s区和p区的都是主族元素
C.铝的第一电离能小于K的第一电离能
D.B电负性和Si相近
查看答案和解析>>
科目:高中化学 来源:2016届青海省高三下高考冲刺一理综化学试卷(解析版) 题型:选择题
X、Y、Z、W为周期表中前20号元素中的四种,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是
A.原子半径:W>Z>Y>X B.气态氢化物的稳定性:X<Z
C.最外层电子数:Y>W D.Y、Z的氧化物都是两性氧化物
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三模拟考试二理综化学试卷(解析版) 题型:选择题
化学与生活、能源、环境等密切相关。下列描述错误的是
A.医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75%
B.“雾霾天气”“温室效应”“光化学烟雾”的形成都与氮的氧化物无关
C.用CO2合成可降解的聚碳酸酯塑料,可以减少“白色污染”
D.氮化硅陶瓷是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川一中高三三模理综化学试卷(解析版) 题型:选择题
用下列装置进行有关实验不能达到预期目的的是

A.用甲装置可制得Fe(OH)3胶体
B.用乙装置可制得金属锰
C.用丙装置验证NaHCO3和Na2CO3的热稳定性
D.用丁装置能较长时间观察到Fe(OH)2白色沉淀
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
纳米氧化亚铜在水的光解等领域具有极大应用潜能,是极具开发前景的绿色环保光催化剂。目前主要的合成方法有电解法、高温固相法等。
(1)有研究表明阳极氧化法成功制得了Cu2O 纳米阵列,装置如图:
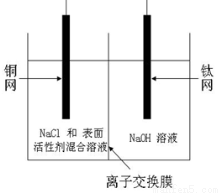
该电池的阳极反应方程式为 离子交换膜为_______(填阳或阴)离子交换膜,铜网应连接电源的_____极。
(2)在高温下用甲烷将粉状CuO 还原也可制得Cu2O。
已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ/mol
②CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H = -846.3 kJ/mol
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157 kJ/mol
则该反应的热化学方程式是:__________。
(3)在相同的密闭容器中,用等质量的三种纳米Cu2O(用不同方法制得)分别进行催化分解水的实验:2H2O(g)  2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
2H2(g)+O2(g) △H>0。水蒸气浓度随时间t变化如下表所示:
序号 |
| 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
①对比实验的温度:T2 T1(填“﹥”“﹤”或“﹦”),原因是___________________。
②实验①前20 min的平均反应速率 v(O2)=
③比较不同方法制得的Cu2O的催化效果应选用__________组实验,原因是___________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:选择题
在某温度时,将n mol•L-1氨水滴入10mL1.0 mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是 ( )
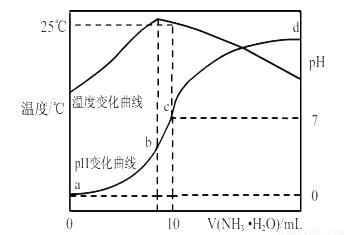
A.a点Kw=1.0×10-14
B.水的电离程度: b > c > a> d
C.b点:C(NH4+) > C(Cl-) > C(H+) > C(OH-)
D.25℃时NH4Cl水解常数为(n-1)×10-7 mol•L-1
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
Mn原子价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)根据元素原子的外围电子排布,可将元素周期表分区,其中Ti属于____________区。Ti的一种氧化物X,其晶胞结构如上图所示,则X的 化学式为 。

(4)某铁的化合物结构简式如右图所示
①组成上述化合物中各非金属元素电负性由大到小的顺序为
(用元素符号表示)
②在右图中用“→”标出亚铁离子的配位键。

(5)NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的配位数为 ,这几个O2-构成的空间构型为 。已知Ni2+与O2-的核间距为anm, NiO的摩尔质量为M g/mol,阿伏加德罗常数用NA表示,则该晶体的密度为________ g/cm3。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列物质中含有极性共价键的离子化合物是( )
A.Ba(OH)2 B.CaCl2 C.H2O D.H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com