
| A. | 常温下水电离出的c(H+)•c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32- | |
| B. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| C. | 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- | |
| D. | 中性透明溶液:K+、Cl-、NO3-、Fe3+、SO42- |
分析 A.常温下水电离出的c(H+)•c(OH-)=10-20的溶液,为酸或碱溶液;
B.MnO4-为紫色;
C.不能使酚酞试液变红的无色溶液,显酸性或中性;
D.Fe3+在pH为4.4左右沉淀完全.
解答 解:A.常温下水电离出的c(H+)•c(OH-)=10-20的溶液,为酸或碱溶液,碱溶液中该组离子之间不反应,可大量共存,故A选;
B.MnO4-为紫色,与无色不符,故B不选;
C.不能使酚酞试液变红的无色溶液,显酸性,酸性溶液中不能大量存在CO32-、ClO-、AlO2-,pH在7至8时该组离子不反应,可共存,故C选;
D.Fe3+在pH为4.4左右沉淀完全,则中性溶液中不能大量存在Fe3+,故D不选;
故选AC.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
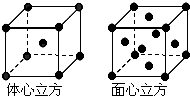 如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
如下表是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题 | ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ⑨ | |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同分异构体: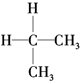 、 、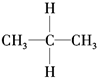 | B. | 烷烃:CH4、 、CH2═CH2 、CH2═CH2 | ||
| C. | 糖类:葡萄糖、蔗糖、纤维素 | D. | 有机高分子:塑料、橡胶、油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量 | B. | 电子层数和核内中子数 | ||
| C. | 电子层数和最外层电子数 | D. | 金属性和非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ca2+、Cl-、SO42- | B. | NH4+、HCO3-、Cl-、K+ | ||
| C. | Cl-、Na+、NO3-、Ca2+ | D. | MnO4-、NO3-、Na+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
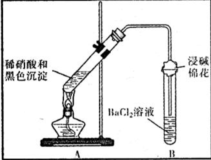 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使它转化为较稳定物质,便于保存和运输 | |
| B. | 增强漂白和消毒作用 | |
| C. | 使转化为较易溶于水的物质 | |
| D. | 增加氯的质量分数,有利于漂白、消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com