
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
| n(H+)-n(OH-) |
| V总 |
| n(H+)-n(OH-) |
| V总 |
| 0.1mol/L×V2L-0.1mol/L×V1L |
| (V1+V2)L |
| V1 |
| V2 |


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| A、常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 |
| B、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO3- |
| C、一定温度下,1L0.5mol?L-1NH4Cl溶液中与2L0.25mol?L-1NH4Cl溶液含NH4+物质的量相同 |
| D、常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、ClO-、SO42-、NH4+可能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中四种粒子之间可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-) |
| B、若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3?H2O |
| C、若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl |
| D、若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成物总能量一定低于反应物总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、人类利用的能量都是通过化学反应获得的 |
| D、在化学反应中只有燃烧反应才能放出热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH4分子的球棍模型: | ||
B、Cl-离子的结构示意图: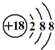 | ||
C、氟化钠的电子式: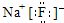 | ||
D、中子数为146、质子数为92 的铀原子
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com