
| A. | 均为0.84 L | B. | 均为0.56 L | C. | ①>② | D. | ①<② |
分析 将Na2CO3溶液逐滴加入到盐酸中,有关反应为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,而将稀盐酸缓缓滴到Na2CO3溶液中,先发生Na2CO3+HCl═NaCl+NaHCO3,盐酸过量时在发生NaHCO3+HCl═NaCl+CO2↑+H2O,结合物质的量的关系解答.
解答 解:25mL 2mol•L-1的Na2CO3溶液中:n(Na2CO3)=0.025L×2mol/L=0.05mol,75mL 1mol•L-1的稀盐酸中:n(HCl)=0.075L×1mol/L=0.075mol,
将Na2CO3溶液逐滴加入到盐酸中,盐酸过量,发生反应为:Na2CO3+2HCl═2NaCl+CO2↑+H2O,
生成气体在标况下的体积为:$\frac{1}{2}$×0.075mol×22.4L/mol=0.84L,
而将稀盐酸缓缓滴到Na2CO3溶液中,先发生反应Na2CO3+HCl═NaCl+NaHCO3,反应消耗0.05molHCl,剩余0.025molHCl,
盐酸过量时在发生反应NaHCO3+HCl═NaCl+CO2↑+H2O,则生成气体在标况下体积为:0.025mol×22.4L/mol=0.56L,
则生成气体在标况下体积①>②,
故选C.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意反应的化学方程式的书写,根据方程式计算,难度中等.


科目:高中化学 来源: 题型:实验题
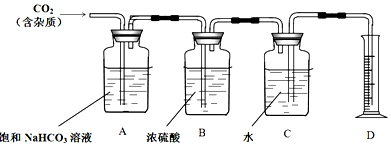
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .硫化氢是一种可燃性气体,实验室在制备硫化氢时,尾气点燃前必须要验纯,硫化氢燃烧时发出淡蓝色色火焰,请写出任意一个硫化氢燃烧的化学反应方程式2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O.实验室制取硫化氢,多余的气体通常用NaOH溶液来吸收.
.硫化氢是一种可燃性气体,实验室在制备硫化氢时,尾气点燃前必须要验纯,硫化氢燃烧时发出淡蓝色色火焰,请写出任意一个硫化氢燃烧的化学反应方程式2H2S+O2$\frac{\underline{\;点燃\;}}{\;}$2S+2H2O.实验室制取硫化氢,多余的气体通常用NaOH溶液来吸收.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3$→_{催化剂△}^{O_{2}}$NO2$\stackrel{H_{2}O_{2}(aq)}{→}$HNO3 | |
| B. | 含2molHCl的浓盐酸$→_{△}^{总量MnO_{2}}$0.5molCl2$\stackrel{石灰石}{→}$0.25molCa(ClO)2 | |
| C. | 饱和NaCl溶液$\stackrel{NH_{3}.CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{稀盐酸}{→}$MgCl2(aq)$\stackrel{通电}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
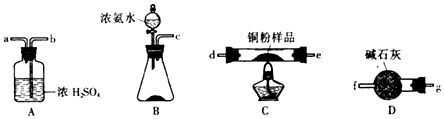
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:2 | D. | 2:3:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁着火不能用CO2灭火 | |
| B. | 钠只有在加热条件下才能与氯气反应 | |
| C. | 浓硫酸有氧化性,稀硫酸没有氧化性 | |
| D. | SO2能使酸性高锰酸钾溶液褪色,说明SO2具有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com