
| A. | R位于第四周期ⅥA族? | |
| B. | R最高价氧化物对应的水化物的化学式为H3RO4 | |
| C. | 元素R气态氢化物的化学式为H2R | |
| D. | R的阴离子具有强还原性 |
分析 某主族元素R原子的质量数为79,R离子含有45个中子和36个电子,R原子核外电子数=原子序数=79-45=34,则为Se元素,R离子核外电子数是36,则R形成的离子为R 2-,则R最外层有6个电子,
A.根据其电子层数和最外层电子数判断;
B.R最外层有6个电子,其最高化合价为+6价;
C.R元素的最低负价为-2价,据此确定其氢化物化学式;
D.Se的阴离子的还原性比硫离子强.
解答 解:某主族元素R原子的质量数为79,R离子含有45个中子和36个电子,R原子核外电子数=原子序数=79-45=34,则为Se元素,R离子核外电子数是36,则R形成的离子为R 2-,则R最外层有6个电子,
A.Se元素,原子核外有4个电子层,位于第四周期,主族元素最外层电子数与其族序数相等,所以Se属于第VIA族元素,故A正确;
B.主族元素其最高正化合价与其族序数相等、最外层电子数相等,所以R元素最高正化合价为+6价,则R元素最高氧化物对应水化物的分子式为H2RO4,故B错误;
C.R元素的最低负价为-2价,所以其氢化物的化学式为H2R,故C正确;
D.Se的阴离子的还原性比硫离子强,硫离子还原性较强,所以Se的阴离子具有强还原性,故D正确;
故选B.
点评 本题考查了原子结构和元素性质,根据质量数和质子数、中子数的关系确定元素是解本题关键,再结合元素周期律、原子结构、元素化合价等知识点分析解答,题目难度中等.


科目:高中化学 来源: 题型:实验题
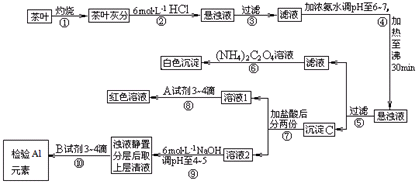
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
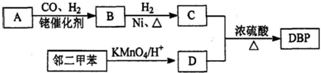

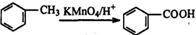


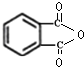 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
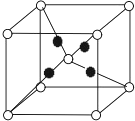 A、B、C、D、E、F、G 原子序数依次增大,A 与 B 不同周期,基态 B 原子核外电子占据 3 个能级,每个能级上电子数相等.D 能形成两种阴离子且电子总数分别为 10、18.E 是短周期电负性最强的元素.基态 F 的价层电子排布式为 ns xnp y,有 n=x+y.基态的+1 价 G 离子核外电子恰好排满三个电子层.
A、B、C、D、E、F、G 原子序数依次增大,A 与 B 不同周期,基态 B 原子核外电子占据 3 个能级,每个能级上电子数相等.D 能形成两种阴离子且电子总数分别为 10、18.E 是短周期电负性最强的元素.基态 F 的价层电子排布式为 ns xnp y,有 n=x+y.基态的+1 价 G 离子核外电子恰好排满三个电子层.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯和丙烯的混合物中总原子数为2NA个 | |
| B. | 在1mol的CH5+中所含的电子数为10NA | |
| C. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| D. | 11.2 L的甲烷气体含有甲烷分子数一定为0.5NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B生成速率与C分解速率相等 | |
| B. | 容器内气体的平均分子量不再变化 | |
| C. | 单位时间生成n mol A,同时生成3n mol B | |
| D. | 容器内气体的密度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原始社会人类学会利用火,他们以天然气取暖,吃熟食,从事生产活动 | |
| B. | 目前我国广大农村生活做饭使用的都是氢能源 | |
| C. | 多能源时代指的是新能源时代,包括核能、太阳能、氢能 | |
| D. | 化石燃料的燃烧没有污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3易液化,液氨常用作制冷剂 | |
| B. | 与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3 | |
| C. | 铵盐受热易分解,因此贮存氮肥时要密封保存,并放在阴凉通风处 | |
| D. | 不能用稀HNO3和金属反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,向 0.1mol•L-1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中的$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$值减小到原来的$\frac{1}{10}$ | |
| B. | 常温时,将PH=1的醋酸和 PH=13的NaOH溶液等体积混合后的溶液:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下0.1mol•L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 室温下,将0.4mol/LHA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c(OH- )>c(H+)+c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com