
| A. | 乙烯、1,3-丁二烯、聚乙烯均能与溴水发生加成反应 | |
| B. | 实验室中要除去乙烷中混有的乙烯气体,可以用通入H2催化加氢的方法 | |
| C. | 沸点由高到低依次为:正戊烷>异戊烷>新戊烷>正丁烷>异丁烷 | |
| D. | 室温光照条件下,可以用CH4与氯气制取纯净的一氯甲烷,该反应属于取代反应 |
分析 A.聚乙烯中不含碳碳双键,与溴水不反应;
B.易引入新杂质氢气;
C.碳原子数越多,沸点越大;相同碳原子时,支链越多,沸点越低;
D.光照下取代反应为链锁反应,产物复杂.
解答 解:A.聚乙烯中不含碳碳双键,与溴水不反应,乙烯、1,3-丁二烯均能与溴水发生加成反应,故A错误;
B.易引入新杂质氢气,应选溴水、洗气除杂,故B错误;
C.碳原子数越多,沸点越大;相同碳原子时,支链越多,沸点越低,则沸点由高到低依次为:正戊烷>异戊烷>新戊烷>正丁烷>异丁烷,故C正确;
D.光照下取代反应为链锁反应,产物复杂,不能制备纯净的一氯甲烷,故D错误;
故选C.
点评 本题考查较综合,涉及有机物的结构与性质、混合物分离提纯、有机反应等,为高频考点,把握有机物的组成、性质及发生的反应为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应过程的离子方程式:2Cu2++3SO32-→Cu2O↓+SO42-+2SO2↑ | |
| B. | 反应过程的离子方程式:2Cu2++3SO32-+2H2O→Cu2O↓+SO42-+4H+ | |
| C. | 加入过量Na2SO3有利于控制溶液的pH | |
| D. | 在酸性条件下,若有14.4g Cu2O变质,转移电子0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
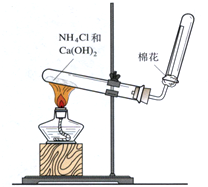 (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径/(×10-10m) | 0.37 | 0.75 | 0.74 | 1.86 | 1.43 | 0.99 | |
| 主要化合价 | 最高正价 | +1 | +5 | +1 | +3 | +7 | |
| 最低负价 | -1 | -3 | -2 | -1 | |||
| A. | Z的氢化物的稳定性都大于Y的氢化物 | |
| B. | 化合物XQ、MQ都是电解质,熔融状态下都能电解 | |
| C. | 元素M、Q、Z的简单离子半径:r(M+)>r(Q-)>r(Z2-) | |
| D. | 在一定条件下,R可以溶于M、Y两种元素的最高价氧化物的水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
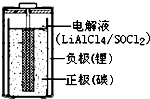 亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃
亚硫酰氯(SOCl2)是一种液态的共价化合物,沸点78.8℃,熔点-105℃查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ν(N2)=0.02 mol•L-1•s-1 | B. | ν(H2)=0.2 mol•L-1•s-1 | ||
| C. | ν(H2)=0.6 mol•L-1•min-1 | D. | ν(NH3)=1.2 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中前三周期为短周期 | |
| B. | 第IA族的元素不全是金属元素 | |
| C. | 元素性质呈现周期性变化的根本原因是元素的相对原子质量呈周期性变化 | |
| D. | 人类可以在周期表中金属与非金属的分界线处,寻找半导材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com