
分析 (1)铁离子遇到硫氰化钾会发生反应,得到的产物使溶液显示红色;
(2)加入酸性KMnO4溶液时,KMnO4溶液紫色褪去,是因为其中还含具有还原性的离子硫氢酸根离子;二氧化硫水溶液具有酸性,可以和硫酸化铁反应,据此回答.
解答 解:(1)铁离子遇到硫氰化钾会发生反应,Fe3++3SCN-=Fe(SCN)3,得到的产物使溶液显示红色,故答案为:Fe3++3SCN-=Fe(SCN)3;
(2)加入酸性KMnO4溶液时,KMnO4溶液紫色褪去,是因为其中还含具有还原性的离子硫氰酸根离子,高锰酸根离子和其发生反应:10Fe(SCN)3+6MnO4-+48H+=15(SCN)2+10Fe3++6Mn2++24H2O,二氧化硫具有酸性,可以和硫酸化铁反应,2H2O+SO2+2Fe(SCN)3=2Fe2++SO42-+6SCN-+4H+,高锰酸根离子和还原性的亚铁离子以及硫氰酸根离子发生反应5Fe2++MnO4-+8H+=2Mn2++5Fe3++4H2O、10SCN-+2MnO4-+16H+=2Mn2++5(SCN)2+8H2O,
故答案为:10Fe(SCN)3+6MnO4-+48H+=15(SCN)2+10Fe3++6Mn2++24H2O;2H2O+SO2+2Fe(SCN)3=2Fe2++SO42-+6SCN-+4H+,5Fe2++MnO4-+8H+=2Mn2++5Fe3++4H2O;10SCN-+2MnO4-+16H+=2Mn2++5(SCN)2+8H2O.
点评 本题考查学生卤素单质的氧化性以及离子的还原性知识,注意知识的迁移和应用是解题的关键,难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
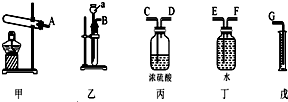
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
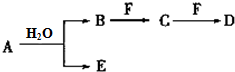 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题:
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如图转化关系,请完成下列问题: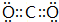 ;D中所含化学键的类型离子键和共价键.
;D中所含化学键的类型离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
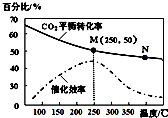
| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 平衡常数:KM>KN | |
| C. | 催化剂可能会影响CO2的平衡转化率 | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将适量氯化铁饱和溶液滴入沸水中并不断搅拌可制得氢氧化铁胶体 | |
| B. | 若需要使用0.100mol/L的CuSO4溶液480ml,可用12g胆矾及相应容器配制 | |
| C. | 用分液漏斗、烧杯、漏斗架、饱和碳酸钠溶液可除去乙酸乙酯中的乙酸 | |
| D. | 实验室从海带里提取碘的过程是:灼烧、溶解、过滤、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:1 | B. | 2:1 | ||
| C. | 1:1 | D. | 缺少条件,无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com