【答案】
分析:Ⅰ:(1)根据白磷和红磷是不同的物质;
(2)根据白磷变为红磷释放能量;根据物质能量的高低与其稳定性的关系;
(3)根据化学反应中能量守恒,放出的能量=反应物的总能量-生成物的总能量,反应物的能量不同,生成物的能量相同,放出的能量也不同,
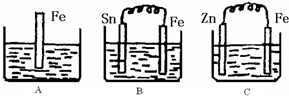
Ⅱ:(1)A、该反应是铁与硫酸反应的离子方程式;
B、根据原电池自发进行的氧化还原反应写出负极的电极反应;
C、根据原电池自发进行的氧化还原反应写出正极的电极反应;
(2)根据B中Sn极是正极,氢离子放电;
(3)根据氢气的体积计算硫酸的物质的量,根据溶液的体积计算物质的量浓度;根据溶液质量的变化等于进入和出去的物质的质量之差来判断;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护.
Ⅲ:(1)判断出反应物和生成物,根据物质的量变化之比等于化学剂量数之比确定反应的化学方程式;
(2)根据v=
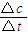
计算反应速率;
(3)①在相同温度下,气体的物质的量之比等于压强之比;
②根据容器内混合气体的平均相对分子质量在数值上等于摩尔质量来判断;
解答:解:Ⅰ:(1)因白磷和红磷是不同的物质,白磷变为红磷是化学变化,故答案为:化学;
(2)因白磷变为红磷释放能量,所以白磷具有的能量大于红磷具有的能量,物质的能量越低,稳定性越好,故答案为:>;红磷,
(3)因化学反应中能量守恒,放出的能量=反应物的总能量-生成物的总能量,反应物的能量大,生成物的能量相同,放出的能量也大,故答案为:>,
Ⅱ:(1)A中是金属铁和硫酸能发生置换反应,原理方程式为:Fe+2H
+=Fe
2++H
2↑;B中Sn、Fe、硫酸构成的原电池,金属铁较活泼,做负极,电极反应为:Fe-2e-=Fe
2+,C中Zn、Fe、硫酸构成的原电池,金属锌较活泼,做负极,金属铁作正极,该极发生的电极反应为:2H
++2e
-=H
2↑,故答案为:Fe+2H
+=Fe
2++H
2↑;Fe-2e-=Fe
2+;2H
++2e
-=H
2↑;
(2)B中Sn(锡)极发生的电极反应为:2H
++2e-=H
2↑,所以氢离子浓度减小,酸性减弱,pH增大,故答案为:增大;
(3)电池总反应为:H
2SO
4+Fe=FeSO
4+H
2↑,n(H
2SO
4)=n(H
2)=
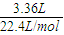
=0.15mol,
则:c(H
2SO
4)=
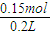
=0.75mol/L,
A中是金属铁和硫酸能发生置换反应,进入的是铁,出去的是氢气,质量增重是54,B中Sn、Fe、硫酸构成的原电池,进入的是铁,出去的是氢气,质量增重是54,C中Zn、Fe、硫酸构成的原电池,进入的是锌,出去的是氢气,质量增重是63,原来三个溶液的质量相等,而溶液质量的变化等于进入和出去的物质的质量之差,所以三个烧杯中液体质量由大到小的顺序为:C>A=B,
故答案为:0.75;C>A=B;
(4)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护,腐蚀速率最小,故答案为:BAC.
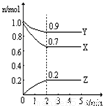
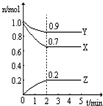
Ⅲ.(1)由图象可知,在反应中,X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,则X、Y为反应物,Z为生成物,同时该反应为可逆反应,相同时间内物质的量的变化比值为:c(X):c(Y):c(Z)=(1.0-0.9):(1.0-0.7):0.2=1:3:2,化学反应中物质的量变化之比等于化学剂量数之比,则化学方程式为Y+3X?2Z,故答案为:Y+3X?2Z;
(2)反应开始至2min,气体Z的平均反应速率v=
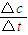
=
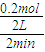
=0.05mol/(L.min),故答案为:0.05mol/(L.min);
(3)①反应达平衡时,气体的总物质的量为:0.9mol+0.7mol+0.2mol=1.8mol,起始时气体的总物质的量为:1.0mol+1.0mol=2.0mol,在相同温度下,气体的物质的量之比等于压强之比,反应达平衡时,此时容器内的压强与起始压强之比为1.8mol:2.0mol=9:10,故答案为:9:10,
②根据物质的摩尔质量M=
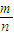
,反应前后气体的质量不变,物质的量减少,所以混合气体的摩尔质量增大,而容器内混合气体的平均相对分子质量在数值上等于摩尔质量,所以平均相对分子质量也增大,故答案为:增大.
点评:本题主要考查了原电池的概念和工作原理知识、化学平衡的变化图象,题目难度不大,可以根据所学知识进行回答,本题要注意化学方程式的确定方法,以及反应速率计算,把握好相关概念和公式的理解及运用.


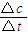 计算反应速率;
计算反应速率;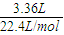 =0.15mol,
=0.15mol,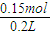 =0.75mol/L,
=0.75mol/L,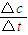 =
=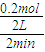 =0.05mol/(L.min),故答案为:0.05mol/(L.min);
=0.05mol/(L.min),故答案为:0.05mol/(L.min);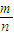 ,反应前后气体的质量不变,物质的量减少,所以混合气体的摩尔质量增大,而容器内混合气体的平均相对分子质量在数值上等于摩尔质量,所以平均相对分子质量也增大,故答案为:增大.
,反应前后气体的质量不变,物质的量减少,所以混合气体的摩尔质量增大,而容器内混合气体的平均相对分子质量在数值上等于摩尔质量,所以平均相对分子质量也增大,故答案为:增大.

 天天练口算系列答案
天天练口算系列答案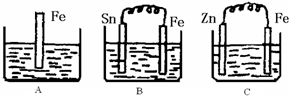
 2Z
2Z 2Z
2Z