
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。

(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用方程式表示)。________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/LNaOH溶液、8.0mol/LNaOH溶液、澄清石灰水、0.01mol/LKMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是______________; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | ①________________________ ②________________________ ③________________________ |
(1)使液体顺利流下(1分)
(2)控制反应温度(1分)
(3) 或
或 (1分)
(1分)
(4)①CO2和O2(1分,气体符号名称顺序可颠倒)
②(共6分)实验操作 预期现象与结论 澄清石灰水、8.0mol·L-1NaOH溶液,并将带火星的木条放在最后一个洗气瓶的出口处。(答案着重号处为各得分点,各1分,试剂要求浓度,数值,单位选对且顺序准确才给分)。 ①若澄清石灰水不变浑浊,木条复燃,则假设1成立;
②若澄清石灰水变浑浊,木条复燃,则假设2成立;
③若澄清石灰水变浑浊,木条不复燃,则假设3成立。(3分)
解析试题分析:结合实验装置图可知恒压滴液漏斗中支管的作用是使液态顺利流下,且实验的关键是控制反应的温度,在配制过程中,如果混入铁离子,会与CO32-发生双水解,(4)关于气体成分的假设还有CO2和O2,分别用澄清石灰水和带火星的木条检验,而且检验氧气前要除去二氧化碳,则①若澄清石灰水不变浑浊,木条复燃,则假设1成立;②若澄清石灰水变浑浊,木条复燃,则假设2成立;③若澄清石灰水变浑浊,木条不复燃,则假设3成立。
考点:化学实验。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案科目:高中化学 来源: 题型:实验题
某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。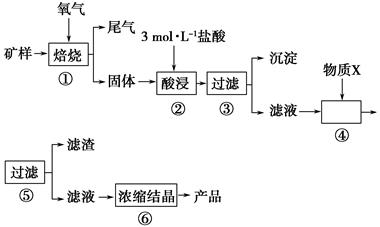
已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某铜矿石中铜元素含量较低,且含有铁、镁、钙等杂质。某小组在实验室中用浸出-萃取法制备硫酸铜:
(1)操作Ⅰ为________。操作Ⅱ用到的玻璃仪器有烧杯、________。
(2)操作Ⅱ、操作Ⅲ的主要目的是________、富集铜元素。
(3)小组成员利用CuSO4溶液与Na2CO3溶液混合反应,制备环保型木材防腐剂Cu2(OH)2CO3悬浊液。多次实验发现所得蓝色悬浊液颜色略有差异,查阅资料表明,可能由于条件控制不同使其中混有较多Cu(OH)2或Cu4(OH)6SO4。
已知Cu(OH)2、Cu2(OH)2CO3,Cu4(OH)6SO4均难溶于水,可溶于酸;分解温度依次为80 ℃、200 ℃、300 ℃。
设计实验检验悬浊液成分,完成表中内容。
限选试剂:2 mol·L-1盐酸、1 mol·L-1 H2SO4、0.1 mol·L-1 NaOH溶液、0.1 mol·L-1 BaCl2溶液、蒸馏水。仪器和用品自选。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,______________________ | ____________,说明悬浊液中混有Cu4(OH)6SO4 |
| 步骤2:另取少量悬浊液于试管中,____________________ | ____________,说明悬浊液中混有Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
下图是实验室制备1,2—二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略)。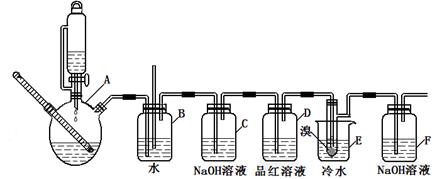
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某课外活动小组根据Mg与CO2的反应原理,探究Mg与NO2的反应及固体产物。该小组通过实验确认Mg能在NO2中燃烧,并对固体产物提出三种假设:
I.假设为:固体产物为MgO II.假设为:______________III.假设为:______________
请回答下列问题:资料信息:2NO2+2NaOH=NaNO3+NaNO2+H2O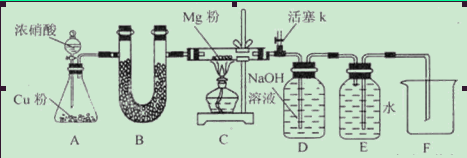
(1)如图连接好仪器,装药品前如何检验装置的气密性_____________________________
(2)装置B中盛装的干燥剂可以是(填序号)___________________
①浓硫酸 ②无水CaCl2 ③碱石灰 ④五氧化二磷
(3)开始打开活塞k,让A中反应进行一段时间,待C中充满红综色气体后,关闭活塞k,再点燃C处酒精灯,同时D中碱液盛的很满,这样做的目的是_________________________
(4)E中收集到的气体对氢气的相对密度是14,该气体是__________________
(5)实验得到固体残留物的质量是实验前Mg粉质量的1.5倍,则假设__________________成立。C中发生的化学反应方程式有_______________________________________________
(6)本实验中存在明显缺陷,改进措施是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组采用温和水溶液法,以CuCl2·2H2O和H2C2O4·2H2O为原料合成新颖结构的草酸铜晶体。为进一步探究草酸铜晶体的性质,现将草酸铜晶体在一定条件下加热分解,对所得气体产物和红色固体产物进行实验和研究。
Ⅰ、用以下装置检验气体产物的成分。
(1)C装置的作用是检验 ,D装置的作用是检验 。(用化学式回答)
(2)用PdCl2溶液检验CO时发生反应的化学方程式为______________________________;
(3)D、E两装置位置能否互换?为什么?_____________________________________。
(4)若需测定气体产物的含量,则A装置能很好地降低实验误差,在实验中,至少有____次使用到A装置,分别起什么作用?_____________________________。
Ⅱ、对固体产物的成分进行探究
①提出合理假设:
假设1:红色固体为Cu ;
假设2:红色固体为Cu2O ;
假设3: 。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| 实验步骤 | 预期现象与结论 |
| 步骤1: | |
| 步骤2: | |
| …… | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用左下图所示装置模拟工业制取并收集ClO2。
(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
(2)A必须添加温度控制装置,除酒精灯、烧杯外,还需要的玻璃仪器有 ,B也必须添加温度控制装置,应该是 (选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
① ;② ;③洗涤;④干燥。
(4)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;量取V1mL试样加入锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;此时发生的离子方程式为: ;
步骤3:加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为 g/L(用含字母的代数式表示)。
(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。




请回答下列问题:
(1)图甲中冷凝水从_________(a或b)进,图乙中B装置的名称为____________
(2)反应中加入过量的乙醇,目的是_________________________________________
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
则试剂a是:____________, 试剂b是____________ , 分离方法III是___________。
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果如下:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质。丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:ks5u
① 甲实验失败的原因是:_______________________________________________
② 乙实验失败的原因是:_______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
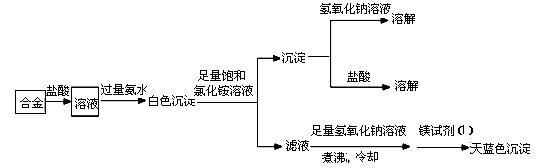
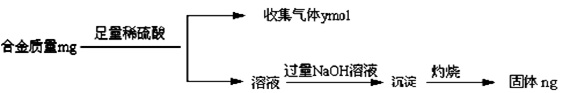
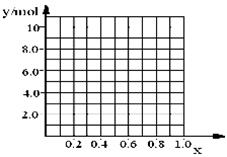
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出
②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵
③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com