


科目:高中化学 来源:不详 题型:单选题
| A.H2SO4的摩尔质量是98 |
| B.2mol N2O和2mol NO2含原子数相同 |
| C.等质量的O2和O3中所含氧原子个数相同 |
| D.等物质的量的CO和CO2中所含碳原子数相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.标准状况下,22.4L甲苯中,含有C—H键数目为8 NA |
| B.t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3 NA |
| C.在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1molSO2转移电子数为5.5 NA |
| D.50g46%的乙醇水溶液中,含氢原子总数目为3 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
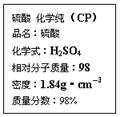
| A.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL |
| B.1 mol Zn与足量的该硫酸反应产生2 g H2 |
| C.该硫酸可以用来干燥硫化氢气体 |
| D.若不小心将该硫酸溅到皮肤上,应立即用NaOH溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.25℃,pH=2的HCl溶液中含有H+的数目为0.01NA |
| B.1mol Na2O2固体中含有的阴阳离子总数为4 NA |
| C.1mol碳烯(:CH2)中含有的电子数8NA |
| D.5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 离子 | Mg2+ | Al 3+ | 物质 | Al(OH)3 |
| 开始沉淀pH | 8.93 | 3.56 | 开始溶解pH | 8.04 |
| 完全沉淀pH | 10.92 | 4.89 | 完全溶解pH | 12.04 |


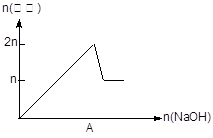

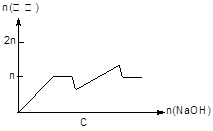
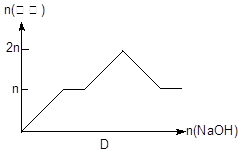
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
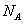 的叙述中正确的有
的叙述中正确的有A.12g金刚石中含4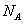 个C-C共价键 个C-C共价键 |
B.2L 0.5 moI.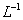 盐酸溶液所含的HCI分子数目为 盐酸溶液所含的HCI分子数目为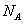 |
C.标准状况下,2.24L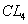 含有的原子数为0.5 含有的原子数为0.5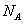 |
D. 7.1 g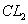 与5.6 g Fe反应,转移的电子总数为0,2 与5.6 g Fe反应,转移的电子总数为0,2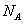 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com