
| A、9:1 | B、1:11 |
| C、1:9 | D、11:1 |
| c(碱)V(碱)-c(酸)V(酸) |
| V(酸)+V(碱) |
| c(碱)V(碱)-c(酸)V(酸) |
| V(酸)+V(碱) |
| 0.1mol/L×yL-0.01mol/L×xL |
| x+y |
| c(碱)V(碱)-c(酸)V(酸) |
| V(酸)+V(碱) |


科目:高中化学 来源: 题型:
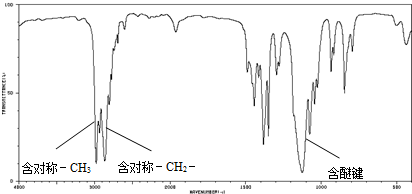
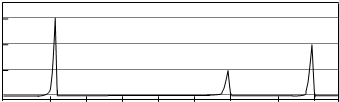
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、体系的压强不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率νA:νB:νC:νD=“m“:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,有CO32-或HCO3-中的一种或两种 |
| B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C、加入硝酸酸化的硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- |
| D、加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
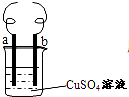 用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解液,如图所示,则下列说法正确的是( )
用铁丝(电极a)、铜丝(电极b)和CuSO4溶液可以构成原电池或电解液,如图所示,则下列说法正确的是( )| A、构成原电池时b极反应式为:Cu2++2e-=Cu |
| B、构成电解池时a极质量一定减少 |
| C、构成电解池时b极质量可能减少也可能增加 |
| D、构成的原电池或电解池工作后,两电极均产生大量气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| A、该反应的焓变为正值 |
| B、恒温下,增大压强,平衡正向移动 |
| C、升高温度,逆反应速率减小 |
| D、该反应化学方程式为CO+H2O=CO2+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
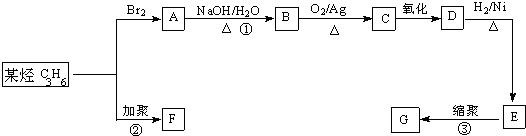
| ① |
| ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com