
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种试剂,按如下步骤操作:

(1)图中三种试剂分别为:A___________、B___________、C____________.
(2)①加入过量A的目的是___________________________;
②加入过量B的目的是_____________________________;
③加热煮沸的目的是_______________________________;
④操作Ⅰ和操作Ⅱ的名称分别是_______、_______。
【答案】Ba(OH)2 K2CO3 盐酸 除尽Mg2+和SO42 除尽过量的Ba2+ 使过量的HCl挥发 过滤 蒸发
【解析】
利用MgCl2和MgSO4能与Ba(OH)2形成Mg(OH)2沉淀、BaSO4沉淀,可先向混合溶液中加入足量或过量的Ba(OH)2溶液,待充分反应后,所得溶液为KCl与过量Ba(OH)2的混合溶液;接下来加入过量K2CO3再把多余的Ba(OH)2除去,过滤后的溶液为KCl、KOH及过量的K2CO3的混合溶液;利用KOH、K2CO3与HCl反应生成KCl,滴加适量稀HCl到不再放出气泡时,得到的溶液即为纯净的KCl溶液,最后经蒸发结晶可得到氯化钾晶体。
(1)分析可知A为Ba(OH)2,B为K2CO3,C为盐酸;
(2)A为氢氧化钡,氢氧化钡可以将MgCl2、MgSO4中的镁离子和硫酸根离子除去,加入过量氢氧化钡,可使镁离子和硫酸根离子完全生成沉淀而除去;
加入过量的K2CO3溶液可使滤液中混有的Ba(OH)2或反应生成的BaCl2完全反应而除去;
反应后加入盐酸除去KOH、K2CO3,加热煮沸,可除去HCl;
操作Ⅰ为过滤操作,用于分离沉淀和溶液,操作Ⅱ为物质的溶液获得晶体的方法,为蒸发结晶。


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】用双线桥表示下列反应的电子转移方向和数目:
①Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O__________
②3Cl2+6KOH===5KCl+KClO3+3H2O_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)被称为21世纪的新型燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
(1)该工艺的总反应为3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
CH3OCH3(g)+CO2(g) ΔH=_________,化学平衡常数K=______________(用含K1、K2、K3的代数式表示)。
化学反应方程式 | 化学平衡常数 | |
①CO(g)+2H2(g) | ΔH1=-99 kJmol-1 | K1 |
②2CH3OH(g) | ΔH2=-24 kJmol-1 | K2 |
③CO(g)+H2O(g) | ΔH3=-41 kJmol-1 | K3 |
(2)某温度下,将8.0molH2和4.0molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
CH3OCH3(g)+H2O(g),10 分钟后反应达平衡,测得二甲醚的体积分数为25%,则用H2表示的反应速率为_________,CO的转化率为________。
(3)下列措施中,能提高CH3OCH3产率的有________。
A.分离出二甲醚 B.降低温度 C.改用高效催化剂D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示各步变化,A为金属,B为淡黄色固体,且每一物质均含有A元素。

(1)试推断以下物质:
B.____________,C.____________,D.____________,E.____________(填化学式)。
(2)写出B→C的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素原子序数依次喊小,原子半径的大小关系为:r(Y)>r(X)>r(Z), 三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
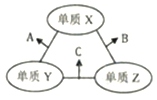
A. X元素位于ⅥA族 B. A难溶于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3 mol A气体和1 mol B气体混合于固定容积为2 L的密闭容器中,发生反应:3A(g)+B(g) ![]() C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
C(g)+2D(s)。2 min末该反应达到平衡,生成D的物质的量随时间的变化情况如图所示。下列判断正确的是( )
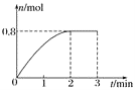
A. 若混合气体的密度不再改变时,该反应不一定达到平衡状态
B. 2 min后,加压会使正反应速率加快,逆反应速率变慢
C. 反应过程中A和B的转化率之比为3∶1
D. 开始到平衡,用A表示的化学反应速率为0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素。如图是实验室从海藻里提取碘的流程的一部分。下列判断正确的是
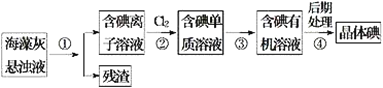
A. 步骤④的操作是过滤
B. 可用淀粉溶液检验步骤②的反应是否进行完全
C. 步骤①、③的操作分别是过滤、萃取
D. 步骤③中加入的有机溶剂可能是酒精或四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com