

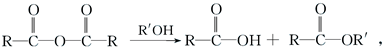

 .
. .
.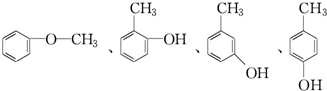 .
.分析 D为苯的同系物,且与氯气反应生成E,E与NaOH的水溶液发生取代反应生成F,F与浓溴水混合不产生白色沉淀,结合E的分子式C7H7,可推得D为 、E为
、E为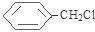 、F为
、F为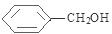 .根据信息可知反应①是取代反应,则A的结构简式为
.根据信息可知反应①是取代反应,则A的结构简式为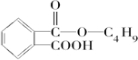 ;反应④为酯化反应,则J为
;反应④为酯化反应,则J为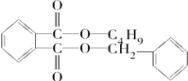 ,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为 ,B与E(
,B与E( )发生取代反应生成J.
)发生取代反应生成J.
解答 解:D为苯的同系物,且与氯气反应生成E,E与NaOH的水溶液发生取代反应生成F,F与浓溴水混合不产生白色沉淀,结合E的分子式C7H7,可推得D为 、E为
、E为 、F为
、F为 .根据信息可知反应①是取代反应,则A的结构简式为式为
.根据信息可知反应①是取代反应,则A的结构简式为式为 ;反应④为酯化反应,则J为
;反应④为酯化反应,则J为 ,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
,控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为 ,B与E(
,B与E( )发生取代反应生成J.
)发生取代反应生成J.
(1)根据分析可知,E为 ,E中的官能团为氯原子,F的结构简式为:
,E中的官能团为氯原子,F的结构简式为: ,F中官能团为-OH,羟基的电子式为
,F中官能团为-OH,羟基的电子式为 ,
,
故答案为:氯原子; ;
;
(2)A+F→J的化学方程式为 ,
,
故答案为: ;
;
(3)根据上面的分析可知,反应①为取代反应,反应④为取代反应,
故答案为:取代反应;取代反应;
(4)F为 ,F的属于芳香烃衍生物的同分异构体的结构简式为
,F的属于芳香烃衍生物的同分异构体的结构简式为 ,
,
故答案为: ;
;
(5)C4H9OH的同分异构体中属于醇类的有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2C(OH)CH3、(CH3)2CHCH2OH,共4种,其中具有手性碳原子的同分异构体的结构简式为:CH3CH2CH(OH)CH3,
故答案为:4;CH3CH2CH(OH)CH3.
点评 本题考查有机的推断与合成,注意根据转化中有机物结构特点进行推断,熟练掌握官能团的结构与性质,注意对题目信息的应用,是对有机化学基础的综合考查,难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
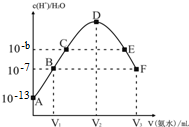
| A. | E溶液中存在:c(NH4+)>c(SO42-)>c(OH-)>c(H+) | |
| B. | 稀硫酸的浓度为0.1mol/L | |
| C. | C点溶液pH=14-b | |
| D. | V2=20 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 9 6 | B. | 5 6 6 | C. | 3 9 7 | D. | 4 6 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | O=O | C=O | H=O | C=H |
| E/(kJ mol-1) | 496 | 799 | 460 | ? |
 |  |  |
| 图1 | 图2 | 图3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
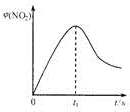
| t/min | t0 | t1 | t2 | t3 | t4 | t5 |
| Φ(NO2) | $\frac{1}{3}$ | 0.30 | $\frac{4}{15}$ | $\frac{1}{6}$ | $\frac{1}{15}$ | $\frac{1}{15}$ |
| Φ(SO2) | $\frac{2}{3}$ | $\frac{19}{30}$ | 0.60 | 0.50 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

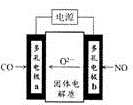
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
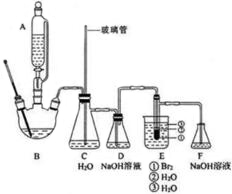 1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.
1,2-二溴乙烷是常用的有机合成中间体,某小组用如下装置合成1,2-二溴乙烷.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 1,2-二溴乙烷 | 131.4 | 2.18 | 微溶 |
| 溴 | 58.8 | 3.12 | 微溶 |
| 乙醇 | 78.5 | 0.79 | 溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com