
【题目】Ⅰ.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
①2NO(g)+Cl2(g)2ClNO(g) 平衡常数为K1;
②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) 平衡常数为K2。
(1)4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
(2)若反应①在温度T下达到平衡时,平衡常数为K1,升高温度后K1增大,则正反应的焓变△H____0(填“>”、“<”或“=”)。若平衡后在其他条件不变的情况下,充入少量Cl2,Cl2的转化率___________(填“变大”、“变小”或“不变”,下同),![]() 的值___________。
的值___________。
Ⅱ.近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)![]() CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。
CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液态收集物中主要产物的质量分数如图3所示。关于该方法,下列推测合理的是________。

A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
【答案】![]() > 变小 变小 ACD
> 变小 变小 ACD
【解析】
Ⅰ.(1)已知:①2NO(g)+Cl2(g)2ClNO(g) 平衡常数为K1;②2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) 平衡常数为K2,则2![]() ②-①既得4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)所以K=
②-①既得4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)所以K=![]() ;(2)因为升高温度K1增大,所以正反应为吸热反应,故△H>0;其他条件不变的情况下,充入少量Cl2,Cl2的转化率变小;由于2NO(g)+Cl2(g)2ClNO(g)增加Cl2的量,虽然平衡向正向移动,但C(Cl2)增加的更大,所以
;(2)因为升高温度K1增大,所以正反应为吸热反应,故△H>0;其他条件不变的情况下,充入少量Cl2,Cl2的转化率变小;由于2NO(g)+Cl2(g)2ClNO(g)增加Cl2的量,虽然平衡向正向移动,但C(Cl2)增加的更大,所以![]() 变小;Ⅱ. A.反应温度超过300℃时,乙酸乙酯的质量分数开始降低,乙醚的质量分数开始升高,所以A合理;B.对于液体物质来说压强对平衡影响较小,所以增大体系压强,对乙醇平有衡转化率影响不大,所以B不合理;C.因为液态收集物中乙醛初期很大,但是慢慢随着乙酸乙酯的增大而减少,所以乙醛应该为中间产物,,所以C合理;D.催化剂有选择性,如果选择优质催化剂,可以减少副反应发生,所以D合理,故本题答案为:ACD。
变小;Ⅱ. A.反应温度超过300℃时,乙酸乙酯的质量分数开始降低,乙醚的质量分数开始升高,所以A合理;B.对于液体物质来说压强对平衡影响较小,所以增大体系压强,对乙醇平有衡转化率影响不大,所以B不合理;C.因为液态收集物中乙醛初期很大,但是慢慢随着乙酸乙酯的增大而减少,所以乙醛应该为中间产物,,所以C合理;D.催化剂有选择性,如果选择优质催化剂,可以减少副反应发生,所以D合理,故本题答案为:ACD。


科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 甲烷分子中5个原子在同一平面内B. 乙烷分子中所有原子不都在同一平面内
C. 苯分子为平面正六边形结构D. 聚乙烯分子是由结构单元重复组成的高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2溶液与氯气反应的离子方程式正确的是( )
A.2Fe2++Cl2=2Fe3++2Cl-
B.2FeCl2+Cl2=2FeCl3
C.Fe2++Cl2=Fe3++2Cl-
D.FeCl2+Cl2=FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、SO42-、CO32-,现取三份100mL溶液进行如下实验:
a. 第一份加入AgNO3溶液有沉淀产生;
b. 第二份加足量NaOH溶液加热后,收集到气体0.04mol;
c. 第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,回答下列问题
(1)该溶液中一定存在的离子是_____________,可能存在的离子是____________。
(2)求一定存在阳离子的浓度或浓度的取值范围______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、硫酸盐以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
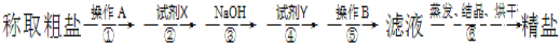
(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)判断试剂X过量的方法是________________________。
(3)写出第④步中涉及反应的化学方程式____________________。
(4)第⑤步操作中得到的固体成分有:泥沙、CaCO3、Mg(OH)2、__________(填化学式)。
(5)此实验方案尚需完善,具体步骤是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1mol/|LCH3COONa 与0.lmol/LHCl 溶液等体积混合: c(Na+)=c(Cl-)>c(OH-)>cCH3COO-)
B. 0.lmol/LNH4Cl与0.lmol/L 氨水等体积浪合(pH>7): c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C. 0.1mol/LNa2CO3与0.lmol/LNaHCO3溶液等体积混合:2/3c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D. 0.1mol/LNa2C2O4与0.lmol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的ΔH=-12.1 kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6 kJ·mol-1,则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ·mol-1 B. -43.5 kJ·mol-1 C. +43.5 kJ·mol-1 D. +67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。

请回答下列问题:
(1)操作①应包括下列操作中的____________。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________。
(3)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+____(填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+) _______c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3 转化为CaO2过程中,Ca原子的利用率__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com