
| A. | 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠 | |
| B. | 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大 | |
| C. | 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大 | |
| D. | 对于同一元素而言,原子的逐级电离能越来越大 |
分析 A.元素的第一电离能是指气态原子失去1个电子形成气态阳离子克服原子核的引力而消耗的能量,原子越稳定其第一电离能越大;
B.同一周期元素的第一电离能随着原子序数的增大而呈增大趋势;
C.ns2np6(当只有K层时为1s2)的原子达到稳定结构,性质稳定,第一电离能都较大;
D.对于同一元素来说,原子的电离能随着原子失去电子个数的增多而增大.
解答 解:A.钾元素的第一电离能小于钠元素的第一电离能,说明钾失电子能力比钠强,所以钾的活泼性强于钠,故A正确;
B.同一周期元素原子半径随着原子序数的增大而减小,第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于第IIIA族元素,第VA族元素大于第VIA族元素,故B错误;
C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子达到稳定结构,再失去电子较难,所以其第一电离能较大,故C正确;
D.对于同一元素来说,原子失去电子个数越多,其失电子能力越弱,所以原子的电离能随着原子失去电子个数的增多而增大,故D正确;
故选B.
点评 本题考查了电离能的有关知识,根据元素周期律来分析解答即可,注意同周期元素第一电离能的异常现象,为常考查点.


科目:高中化学 来源: 题型:选择题
| A. | 乙醛的结构简式:CH3COH | B. | C2H2分子的结构式:CH≡CH | ||
| C. | CH4分子的比例模型: | D. | 异丁烷的键线式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4mol | B. | 5mol | C. | 6mol | D. | 7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol聚乙烯含有的原子数目为0.6NA | |
| B. | 一定条件下,26 g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为2NA | |
| C. | 1 mol甲基含10 NA个电子 | |
| D. | 标准状况下,22.4L CHCl3中所含有的原子总数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.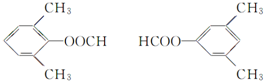 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种较弱的化学键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 常温下,Cl2、Br2、I2的状态从气态、液态到固态,主要原因是分子间作用力在逐渐增大 | |
| D. | 最外层能达到稳定结构的微粒只是稀有气体的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
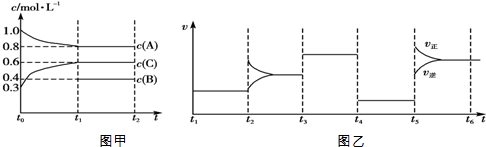
| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com