
A.①>② B.①<② C.①=② D.不能确定
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源:学习高手必修一化学人教版 人教版 题型:021
|
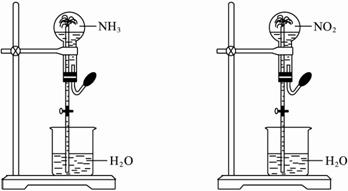
如下图,同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3和②NO2,进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
| |
A. |
①>② |
B. |
①<② |
C. |
①=② |
D. |
不能确定 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省南安一中高一下学期期中考试化学试卷(带解析) 题型:填空题
氮及其化合物在工农业生产等方面有广泛应用,研究其性质有重要意义。
A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B。用圆底烧瓶收集干燥的B。按如图装置,引发紫色石蕊溶液上喷,可以得到蓝色喷泉;A与浓H2SO4反应,放出无色气体C。用圆底烧瓶收集干燥的C,仍按下图装置,引发紫色石蕊溶液上喷,可以得到红色喷泉。
(1)写出A与浓NaOH溶液共热生成B的离子方程式
;
(2)可用于除去B中水分的干燥剂是______________;
收集气体C的方法是______________________________;
(3)引发紫色石蕊溶液上喷的操作是 ;
(4)在同温同压下,相同体积的两个烧瓶分别充满气体B和气体C,做喷泉实验后,水都充满烧瓶,两个烧瓶中所得溶液的物质的量浓度之比是_____________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省高三上学期期末考试化学试卷(解析版) 题型:填空题
(12分)V、W、X、Y、Z是五种常见元素,其中V、W、X、Y四种短周期元素在周期表中的位置如下图所示:V、W的最简单气态氢化物M、N混合时有白烟生成,M能使湿润的pH试纸变蓝。Z是人体血红蛋白中存在的金属元素。请填写下列空白:

(1)W的原子结构示意图为 ;
(2)二氧化钛(TiO2)与X的单质、Y的单质高温下反应生成两种
化合物,这两种化合物均由两种元素组成。其反应的化学方程
式为 ;
(3)含X元素的一种化合物A与Y的最高价氧化物C之间有如下的反应关系:

若E为白色沉淀,则E物质的化学式为 ;
(4)含同价态X、Z简单离子的溶液中滴加NaOH溶液,X、Z两元素先后沉淀,X(OH)n完全沉淀的pH是4.7,Z(OH)n完全沉淀的pH是2.8,则ksp[X(OH)n]
(填“>”或 “<”) ksp[Z(OH)n];
(5)联氨(N2H4)也叫做肼,是重要的火箭燃料。以次氯酸钠溶液氧化M,能获得肼的稀溶液。其反应的离子化学方程式为 。同温同压下,将a L M气体和b LN气体通入水中,若所得溶液的pH=7,则a b(填“>"或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三第三次模拟考试化学试卷 题型:填空题
(9分)氮及其化合物与人们的生活息息相关。
(1)氮元素在周期表中的位置是 。
(2)实验室可用铜与稀硝酸反应制取NO,其离子方程式是 。为防止环境污染,可用碱液吸收氮的氧化物。NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该化学方程式是 。
(3)已知:① CH4(g) + 4 NO2(g) = 4 NO(g) + CO2(g) +2 H2O(g) △H= -574 kJ·mol-1
② CH4(g) + 4 NO(g) = 2 N2(g) + CO2(g) + 2 H2O(g) △H= -1160 kJ·mol-1
根据①和②,标准状况下,4.48 L CH4恰好将NO2转化为N2时,△H= 。
由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H -574 kJ·mol-1
(4)同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气完全转化为N2,则原混合
气中 NO和NO2的体积比是 。
(5)含有1mol HNO3的稀硝酸分别与不同质量的铁粉,所得氧化产物a、b与铁粉物质的量关系如下图所示。 b是 n3 = p=

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com