
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和 去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
A.1mol 环戊二烯( ![]() )中含有σ键的数目为1NA
)中含有σ键的数目为1NA
B.环戊二烯中碳原子的杂化方式有 sp3 和 sp2
C.二茂铁属于分子晶体
D.二茂铁分子中的化学键有极性共价键、非极性共价键和配位键
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z均为主族元素,分析表中数据,判断下列说法正确的是(a≠b)( )
元素 | X | Y | Z |
最外层电子数 | a | b | a |
原子半径/nm | 0.154 | 0.130 | 0.211 |
A.X与Y位于同一主族,且X在Y的上一周期
B.X与Z位于同一主族,且X在Z的下一周期
C.X与Z位于同一周期,且X的原子序数小于Z的原子序数
D.X与Z位于同一主族,且X的原子序数小于Z的原子序数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
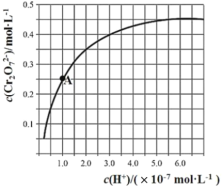
A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,元素周期表的第7周期已被填满。2017年,第113号、115号、117号和118号元素有了中文名称:鉨![]() 、镆
、镆![]() 、
、![]()
![]() 、
、![]()
![]() 。已知第113号元素与
。已知第113号元素与![]() 元素同主族,根据元素周期律的知识,下列预测或说法合理的是
元素同主族,根据元素周期律的知识,下列预测或说法合理的是
A.![]() 的最高价氧化物对应的水化物可能具有两性
的最高价氧化物对应的水化物可能具有两性
B.![]() 在元素周期表中的位置是第7周期第ⅤB族
在元素周期表中的位置是第7周期第ⅤB族
C.![]() 的非金属性比
的非金属性比![]() 的弱
的弱
D.![]() 在元素周期表的所有元素中非金属性最强
在元素周期表的所有元素中非金属性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。镧 (La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,有 关其说法正确的是

A.属于金属晶体
B.该合金的化学式为 La7Ni12
C.其熔点比组分金属高,硬度比组分金属大
D.设该结构单元的体积为 Vcm3,NA 为阿伏伽德罗常数,合金的摩尔质量为 M g/mol。则该合金的密度为ρ= ![]() g/ cm3
g/ cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g)+I2(g)![]() 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C. 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素. 铁、钴、镍都是很好的配位化合物形成体.
(1)[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。H2O 和 N H3 中与 Co2+配位能力较强的是_____,[Co(H2O)6]2+中 Co2+的配位数为___;从轨道重叠方式看,NH3 分子中的化学键类型为___ , H2O 分子的立体构型为___。
(2)铁、镍易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数 遵循 18e-规则。如:Fe(CO)5,则镍与 CO 形成的配合物化学式为_________。常温下 Fe(CO)5 为 黄色油状液体,则 Fe(CO)5 固态为_____晶体。Fe(CO)5 晶体中存在的作用力有___,写出与 CO 互为等电子体的一种阴离子的离子符号_____,Fe(CO)5 中σ键和π键数目之比为______。
(3)一种铁单质其晶胞与钠、钾晶胞相同,如果该铁单质的晶胞参数为 a cm,则相距最近的两 个铁原子核间距为_____cm (用含 a 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像正确的是
A. 向氢氧化钙和氢氧化钠混合溶液中通入二氧化碳
B. 用氢氧化钠溶液滴定等浓度的盐酸和醋酸
C. 向氢氧化钠溶液中通入二氧化碳
D. 氯化氢和氯气的混合气体通入氢氧化钠溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电解质在水溶液中的平衡能了解它的存在形式。
(1)已知部分弱酸的电离常数如下表:
化学式 | HF | H2CO3 | H2S |
电离平衡常数K(25℃) |
|
|
|
①写出H2S的Ka1的表达式:________________。
②常温下,pH相同的三种溶液NaF、Na2CO3、Na2S,物质的量浓度最小的是_______。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是_______________。
(2)室温下,用0.100 mol·L-1 盐酸溶液滴定20.00 mL 0.100 mol·L-1 的氨水溶液,滴定曲线如图所示。(忽略溶液体积的变化,①②填“>”“<”或“=”)
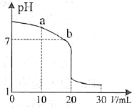
①a点所示的溶液中c(NH3·H2O)___________c(Cl-)。
②b点所示的溶液中c(Cl-)___________c(NH4+)。
③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c(H+)之比为__________。
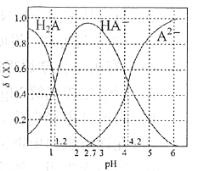
(3)二元弱酸H2A溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示。则H2A第二级电离平衡常数Ka2=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com