
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 化学方程 | 焓变ΔH/kJ·mol-1 | 活化能Ea/kJ·mol-1 | |
| 甲 烷 氧 化 | CH4(g)+2O2(g)=== CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=== CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸 汽 重 整 | CH4(g)+H2O(g)=== CO(g)+3H2(g) | +206.2 | 240.1 |
| CH4(g)+2H2O(g)=== CO2(g)+4H2(g) | +165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)===CO2(g)+H2(g)的ΔH=________kJ·mol-1。
(2)在初始阶段,甲烷蒸汽重整的反应速率________甲烷氧化的反应速率(填“大于”“小于”或“等于”)。
(3)对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可表示平衡常数(记作Kp),则反应CH4(g)+H2O(g)CO(g)+3H2(g)的Kp=________,随着温度的升高,该平衡常数________(填“增大”“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于
___________________________________________________________________。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:
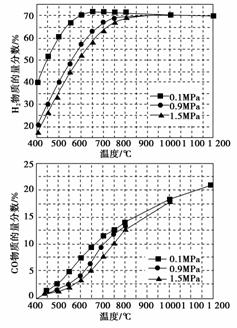
①若要达到H2物质的量分数>65%、CO物质的量分数<10%,以下条件中最合适的是________。
A.600 ℃,0.9 MPa B.700 ℃,0.9 MPa
C.800 ℃,1.5 MPa D.1 000 ℃,1.5 MPa
②画出600 ℃,0.1 MPa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)的变化趋势示意图:
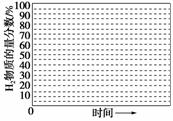
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是
___________________________________________________________________。
【解析】 (1)由题给信息知:①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1;
②CH4(g)+2H2O(g)===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1。根据盖斯定律,由②-①可得CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=(+165.0 kJ·mol-1)-(+206.2 kJ·mol-1)=-41.2 kJ·mol-1。
(2)甲烷氧化的反应为放热反应,甲烷蒸汽重整的反应为吸热反应,初始阶段,甲烷氧化反应的活化能低于甲烷蒸汽重整反应的活化能,故前者反应速率较后者快。
(3)据题中Kp的描述可知,Kp= 。温度升高,平衡正向移动,Kp增大。
。温度升高,平衡正向移动,Kp增大。
(4)分析表中反应的焓变可知,甲烷氧化放出热量,为甲烷蒸汽重整提供所需能量。
(5)①由图可知:
| 达到H2物质的量分数>65%时 | |||
| 压强 | 0.1 MPa | 0.9 MPa | 1.5 MPa |
| 温度 | ≥530 ℃ | ≥675 ℃ | ≥720 ℃ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
下列有关甲苯的实验事实中,能说明侧链对对苯环性质有影响的是 ( )
A.甲苯通过硝化反应生成三硝基甲苯
B.甲苯能使酸性高锰酸钾溶液褪色
C.甲苯燃烧产生很浓的黑烟
D.1 mol甲苯与3 mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A.在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN的大
C.25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D.2SO2+O2==2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):NN为942、OO为500、NN为154,则断裂1 mol NH键所需的能量(kJ)是( )

A.194 B.391
C.516 D.658
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol/L的二元酸H2A溶液的pH=4.0,则下列说法中正确的是
( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有c(Na+)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
B.25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热不相等
C.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能
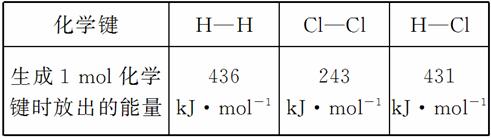
则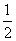 H2(g)+
H2(g)+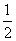 Cl2(g)===HCl(g) ΔH=-183 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-183 kJ·mol-1
D.任何化学反应都伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.把a L 0.1 mol·L-1的CH3COOH溶液与b L 0.1 mol·L-1的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-)
B.把0.1 mol·L-1的NaHCO3溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+)
C.向1 mol·L-1的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
盐酸和K2CO3反应时,能使反应的最初速率明显加快的是( )
A.将盐酸用量增加一倍 B.盐酸的浓度增加一倍,用量减半
C.温度升高30 ℃ D.增加K2CO3粉末的量
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1 L的密闭容器中,进行如下反应:A(g)+2B(g)C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
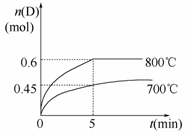
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变
B.混合气体中c(A)不变
C.v正(B)=2v逆(D)
D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com