
【题目】请写出以下溶液的酸碱性(选填“酸性、碱性、中性”)
(1)NaCl溶液______________;
(2)(NH4)2SO4溶液 ___________;
(3)Na2CO3溶液 ___________;
(4)FeCl3溶液 _____________;
(5)CH3COONa溶液 ____________。
【答案】中性 酸性 碱性 酸性 碱性
【解析】
盐是酸碱发生中和反应的产物,根据盐的水解规律:有弱才水解,谁弱谁水解,谁强显谁性分析判断。
(1)NaCl是强酸HCl与强碱NaOH发生中和反应的产物,是强酸强碱盐,不发生水解反应,对水的电离平衡无影响,因此溶液显中性;
(2)(NH4)2SO4是强酸H2SO4与弱碱NH3H2O发生中和反应的产物,是强酸弱碱盐,在溶液中NH4+发生水解反应:NH4++H2O![]() NH3H2O+H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
NH3H2O+H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
(3)Na2CO3是强碱NaOH与弱酸H2CO3发生中和反应的产物,是强碱弱酸盐,在溶液中CO32-发生水解反应:CO32-+H2O![]() HCO3-+OH-,产生的HCO3-会进一步发生水解反应:HCO3-+H2O
HCO3-+OH-,产生的HCO3-会进一步发生水解反应:HCO3-+H2O![]() H2CO3+OH-,当最终达到水解平衡时,溶液中c(OH-)>c(H+),溶液显碱性;
H2CO3+OH-,当最终达到水解平衡时,溶液中c(OH-)>c(H+),溶液显碱性;
(4)FeCl3溶液是强酸HCl与弱碱Fe(OH)3发生中和反应的产物,是强酸弱碱盐,在溶液中Fe3+发生水解反应:Fe3++3H2O![]() Fe(OH)3+3H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
Fe(OH)3+3H+,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性;
(5)CH3COONa是强碱NaOH与弱酸CH3COOH发生中和反应的产物,是强碱弱酸盐,在溶液中CH3COO-发生水解反应:CH3COO-+H2O![]() CH3COOH+OH-,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性。
CH3COOH+OH-,当最终达到水解平衡时,溶液中c(H+)>c(OH-),溶液显酸性。


科目:高中化学 来源: 题型:
【题目】有一可逆反应:2A(g)+3B(g) ![]() xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:①0.8 mol A+1.2 mol B+1.2 mol C+2.4 mol D②1.4 mol A+2.1 mol B+0.6 mol C+1.2 mol D达平衡后,C的质量分数相等,则方程式中x的值为( )
xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:①0.8 mol A+1.2 mol B+1.2 mol C+2.4 mol D②1.4 mol A+2.1 mol B+0.6 mol C+1.2 mol D达平衡后,C的质量分数相等,则方程式中x的值为( )
A. 1B. 2C. 3D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醛和苯酚为主要原料,经下列转化可合成酚醛树脂和主要的有机合成中间体D(部分反应条件和产物已略去)
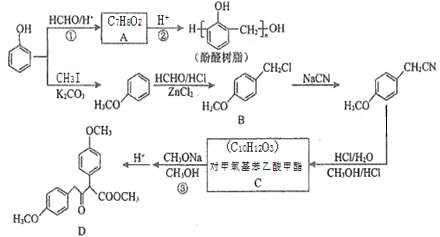
已知:R1CH2COOCH3+R2COOCH3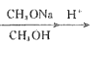 CH3OH+
CH3OH+
请回答下列问题:
(1)C中所含官能团名称为___________;D的化学式为_______。
(2)反应②的化学方程式为_________________。
(3)芳香族化合物E(C8H10O2)与B的水解产物互为同分异构体,1mol E可与2mol NaOH反应,其核磁共振氢谱中有3组峰,且峰面积比为3:1:1,则E有______种可能的结构(不考虑立体异构)。
(4)以CH3OH和CH3ONa为原料(其它试剂任选),设计制备CH3COCH2COOCH3的合成路线:CH3OH![]() ______________。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,下列溶液与1.0×10-5mol/L的NaOH溶液的pH相同的是( )
A. 把pH=6的盐酸稀释1 000倍
B. 把pH=10的Ba(OH)2溶液稀释10倍
C. 把pH=8和pH=10的NaOH溶液等体积混合
D. 把pH=8的NaOH溶液稀释10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)__________________。
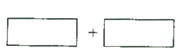
(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中颜色变化,直到加入一滴盐酸,溶液的颜色由____色变为_____,且半分钟不褪色,即停止滴定。
(2)下列操作中使所测氢氧化钠溶液的浓度数值偏高的是________(填序号)。

A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
C、酸式滴定管在滴定前有气泡,滴定后气泡消失
D、读取盐酸体积时,开始俯视读数,滴定结束时仰视读数
E、滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示:则起始读数为_____mL,终点读数为_____mL。
(4)如已知用c(HCl) = 0.1000 mol/L的盐酸滴定20.00 mL的氢氧化钠溶液,测得的实验数据如(3)中记录所示,则该氢氧化钠溶液的浓度c(NaOH) =____mo1/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是 ( )
A. HCO3的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 泡沫灭火器的原理:Al3++3HCO3- ![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C. AgCl电离方程式:AgCl(s)![]() Ag+ (aq)+ Cl-(aq)
Ag+ (aq)+ Cl-(aq)
D. Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.0.1 L 1 mol/L K2SO4 溶液中含有氧原子数为0.4NA
B.67.2L氯气所含的原子数是6NA
C.常温常压下,11.2 LO2含有电子数为8NA
D.在标准状况下,2.24LN2和O2的混合气体所含原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为6A+2 D![]() 3B+4C
3B+4C
B. 反应进行到1 s时,v(A)=v(B)
C. 反应进行到5 s时,B的平均反应速率为0.06mol/(L·s)
D. 反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com