
(15分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
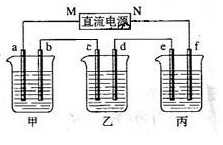
(1) 接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为 极;
②电极b上发生的电极反应为 ;
③列式计算电极b上生成的气体在标准状态下的体积: ;
④电极c的质量变化是 g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因:
甲溶液 ;
乙溶液 ;
丙溶液 ;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(1)①正极
②4OH--4e-=2H2O + O2↑。
③2.8L
④16g
⑤甲增大,因为相当于电解水;乙减小,OH-放电, H+增多。丙不变,相当于电解水。
(2)可以 因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应
【解析】(1)①乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中为K2SO4,相当于电解水,设电解的水的质量为xg。由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol。由方程式2H2+O2 ![]() 2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。
2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。
②甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。
③转移0.5mol电子,则生成O2为0.5/4=0.125mol,标况下的体积为0.125×22.4=2.8L。
④Cu2++2e-=Cu,转移0.5mol电子,则生成的m(Cu)=0.5/2 ×64 =16g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。
(2)铜全部析出,可以继续电解H2SO4,有电解液即可电解。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市邹城二中高二上学期期中质量检测化学试卷 题型:填空题
(14分)下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题: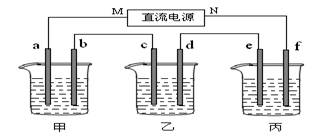
(1)电源的N端为 极;
(2)电极b上发生的电极反应为 ;
(3)电极c上生成的气体在标准状态下的体积: ;
(4)甲溶液的氢氧根离子浓度为 (设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为 ,e电极的材料是: ,f电极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2010年重庆市万州二中高三秋季开学测试化学(理)试题 题型:填空题
(12分)A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42—、OH- |


查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省白鹭洲中学高二下学期第三次月考化学试卷(带解析) 题型:填空题
(10分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。


 (1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。
据此回答问题: ①电源的N端为 极;
①电源的N端为 极; ②电极b上发生的电极反应为 ;
②电极b上发生的电极反应为 ; ③电极b上生成的气体在标准状况下的体积:
③电极b上生成的气体在标准状况下的体积:
 ④电极c的质量变化是 g;
④电极c的质量变化是 g; (2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?  。
。 ⑤电解前后各溶液的pH如何变化。(填增大,减小或不变)
⑤电解前后各溶液的pH如何变化。(填增大,减小或不变) 甲溶液 ;
甲溶液 ; 乙溶液_______;
乙溶液_______; 丙溶液_______;
丙溶液_______;
查看答案和解析>>
科目:高中化学 来源:2013届山东省济宁市高二上学期期中质量检测化学试卷 题型:填空题
(14分)下图所示装置中,甲、乙两个烧杯分别依次盛放200mL饱和食盐水、足量的AgNO3溶液,a、b、c、d四个电极均为石墨电极。接通电源,经过一段时间后,测得乙中d电极质量增加了2.16g。据此回答问题:

(1)电源的N端为 极;
(2)电极b上发生的电极反应为 ;
(3)电极c上生成的气体在标准状态下的体积: ;
(4)甲溶液的氢氧根离子浓度为 (设溶液体积仍为200mL);
(5)欲在丙烧杯中实现铁的表面镀上一层铜,则电解质溶液为 ,e电极的材料是: ,f电极的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com