

分析 (1)升温,化学反应速率加快,反应向着吸热方向进行;
(2)减压,正逆反应速率减慢,反应向着气体系数和增加的方向进行;
(3)减少C的量:正逆反应速率减慢,但是平衡正向移动,所以正反应速率大于逆反应速率;
(4)增加A的量:正逆反应速率加快,但是平衡正向移动,所以正反应速率大于逆反应速率;
(5)使用催化剂:正逆反应速率都加快,但是不会引起化学平衡的移动.
解答 解:(1)升温,正逆化学反应速率迅速加快,反应向着吸热方向进行,即向着逆向进行,所以逆反应速率大于正反应速率,故选B;
(2)减压,正逆反应速率都减慢,反应向着气体系数和增加的方向即逆向进行,所以逆反应速率大于正反应速率,故选C;
(3)减少C的量:正逆反应速率减慢,逆反应速率迅速减慢,但是平衡正向移动,所以正反应速率大于逆反应速率,故选E;
(4)增加A的量:正逆反应速率加快,但是平衡正向移动,所以正反应速率大于逆反应速率,故选A;
(5)使用催化剂:正逆反应速率都加快,但是不会引起化学平衡的移动,故选D.
点评 本题综合考查学生化学反应速率和化学平衡的移动的影响因素等知识,注意知识的归纳和梳理是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24L H2O中含有极性共价键的数目为0.2NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②⑤ | C. | ③⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
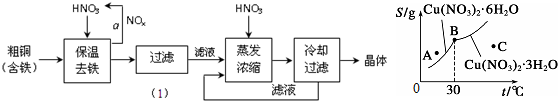
| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
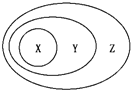
| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是短周期元素中原子半径最大的 | |
| B. | X元素最高价氧化物对应的水化物,可以与其他三种元素最高价氧化物对应的水化物反应 | |
| C. | WZ4分子中每个原子最外层均达到8电子结构 | |
| D. | X元素的氧化物中只存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (增塑剂)②
(增塑剂)② (合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂)
(合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂) 香料)
香料)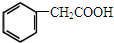 (植物生长刺激素)
(植物生长刺激素)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com