
| A. | 化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物物质的量的增加 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指1秒钟时某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 |
分析 A、化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示,固体或纯液体的浓度变化视为0;
B、因化学反应速率为平均速率,0.8mol/(L•s)是指1s内该物质的浓度变化量为0.8mol/L;
C、化学反应速率是用于描述化学反应快慢的物理量;
D、对有明显现象的化学反应,反应速率越快,反应现象就越明显.
解答 解:A、化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增大来表示,固体或纯液体的浓度变化视为0,不能用于表示反应速率,故A错误;
B、因化学反应速率为平均速率,则化学反应速率为0.8mol/(L•s)是指1s内该物质的浓度变化量为0.8mol/L,故B错误;
C、化学反应速率是用于描述化学反应快慢的物理量,根据化学反应速率可以知道化学反应进行的快慢,故C正确;
D、对有明显现象的化学反应,反应速率越快,反应现象就越明显,对于没有明显现象的反应,反应速率快慢对反应现象影响很小,如中和反应等,故D错误;
故选C.
点评 本题考查化学反应速率,明确化学反应速率的定义及计算表达式、化学反应速率的理解等即可解答,选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 无法计算 | B. | 2.8g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
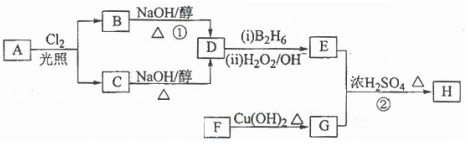
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 晚上发生的是放热反应 | B. | 白天将化学能转化为太阳能 | ||
| C. | 晚上将化学能转化为热能 | D. | 此法可减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
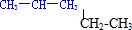 ⑥氕、氘和氚
⑥氕、氘和氚查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃氢气前一定要检验氢气的纯度 | |
| B. | 未使用完的白磷要随时收集起来,并与空气隔绝 | |
| C. | 酒精灯不用时,必须盖上灯帽 | |
| D. | 用CO还原氧化铁时,要先通一会儿CO气体,再加热氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.40mol | B. | 0.50mol | C. | 0.60mol | D. | 0.70mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com