
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。其中以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是( )

A.a电极上的电极反应式为N2H4+2O2-+4e-=N2↑+2H2O
B.电池内电路中,电流方向:电极a→电极b
C.当电极a上消耗1molN2H4时,电极b上被氧化的O2在标准状况下体积为22.4L
D.b极附近的pH值变大
【答案】B
【解析】
该燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+2O2--4e-=N2↑+2H2O,正极上氧气得电子发生还原反应,电极反应式为:O2+4e-=2O2-,电池总反应为:N2H4+O2=N2↑+2H2O,结合离子的移动方向、电流的方向分析解答。
A. 该燃料电池中a极是负极,负极上燃料失电子发生氧化反应,电极反应式为:N2H4+2O2--4e-=N2↑+2H2O,故A错误;
B. 该燃料电池中a极是负极,b极是正极,电池内电路中,电流方向:电极a→电极b,故B正确;
C. 由电池总反应为N2H4+O2=N2↑+2H2O可知,当a电极上有1molN2H4消耗时,b电极上有1molO2被还原,状况不知,所以体积不一定是22.4LO2,故C错误;
D. b极是正极,正极上氧气得电子发生还原反应,电极反应式为:O2+4e-=2O2-,非水溶液,没有产生氢氧根,pH不变,故D错误;
正确答案是B。


科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是

A. 利用甲装置,验证SO2或H2SO3具有氧化性
B. 利用乙装置,验证元素的非金属性:C1>C>Si
C. 利用丙装置,进行NH3的干燥、收集、尾气处理
D. 利用丁装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂钡氧化物二次电池。电池总反应为V2O4+xLi![]() LixV2O4,下列说法正确的是
LixV2O4,下列说法正确的是
A. 该电池充电时,锂极与外电源的负极相连
B. 该电池放电时,Li+向负极移动
C. 该电池充电时阴极的反应为LixV2O4-xe-=V2O4+xLi+
D. 若放电时转移 0.2 mol 电子,则消耗锂 1.4x g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,2NO+Na2O2====2NaNO2,以木炭、浓硝酸、Na2O2为主要原料制备亚硝酸钠的装置如图所示。(加热装置及部分夹持装置已略去)

回答下列问题:
(1)A装置中反应的化学方程式为__________________________________________。
(2)B装置的作用是_________________________________________________。
(3)充分反应后,C中生成的固体除NaNO2外,还可能生成_________(填化学式),为避免杂质的生成,应在B、C之间加一个为_________装置,该装置和所盛放试剂的名称分别是____________。
(4)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为_________( (填标号)。
a.打开弹簧夹,向装置中通入N2 b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸 d.熄灭酒精灯
e.关闭分液漏斗旋塞 f.停止通入N2
(5)D装置用于尾气处理,写出D中反应的离子方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g)=2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol· L-1·min-1 ②v(B)=0.45 mol· L-1·min-1
③v(C)=0.015 mol· L-1·min-1 ④v(D)=0.45 mol· L-1·min-1
则此反应在不同条件下进行最快的是
A.③B.①C.②D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
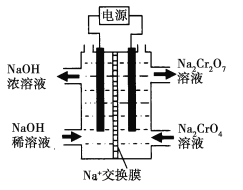
【题目】Cr2O72-、Cr3+对环境具有极强的污染性,含有Cr2O72-、Cr3+的工业废水常采用NaOH沉淀方法除去。
已知:①常温下,Cr3+完全沉淀(c≤1.0×105 mol· L1) 时,溶液的pH为5;NaOH过量时Cr(OH)3溶解生成CrO2-②Cr2O72-还原产物为Cr3+。
请回答下列问题:
(1)写出Cr(OH)3溶于NaOH的离子方程式______________________
(2)常温下,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=___________。
(3)常温下,向50 mL 0.005 mol·L1的Cr2(SO4)3溶液中加入0.24 mol·L1的NaOH溶液50 mL,充分反应后,溶液pH为______。
(4)为了测定工业废水中Na2Cr2O7的浓度,进行如下步骤:
Ⅰ.取100 mL滤液;
Ⅱ.用c mol·L1的标准KMnO4酸性溶液滴定b mL一定浓度的FeSO4溶液,消耗KMnO4溶液b mL;
Ⅲ.取b mL滤液,用上述FeSO4溶液滴定,达到滴定终点时,消耗d mL FeSO4溶液。
①步骤Ⅱ中的滴定过程应选用_______(填“酸式”或“碱式”)滴定管,滴定管装液前的操作是_______。
②步骤Ⅲ的滤液中Na2Cr2O7的含量为_______mol·L1。
(5)利用图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的______极,Na2CrO4生成Na2Cr2O7的离子方程式_______________________。若左侧电极产生标况下2.24L的气体,则通过交换膜的钠离子的数目为___________________
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积恒定的密闭容器中发生反应:![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
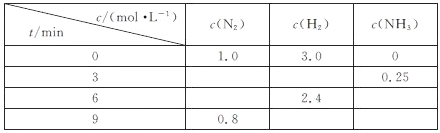
反应刚好达到平衡状态时
A. t=6min
B. c(NH3)=0.4mol·Lˉ1
C. 容器内的气体分子数N(N2):N(H2):N(NH3)=1:3:2
D. H2的正反应速率等于N2的逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标况下2.24L的苯完全燃烧生成CO2的分子数目为0.6NA
B.7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.3NA个
C.18g的D2O含有的中子数目均为10NA
D.42g的C2H4与C3H6的混合物中含有的共价键数目为9 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com