
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.8 mol·L-1。下列判断错误的是( )
A. x=4 B. 2 min内B的反应速率为0.1 mol·(L·min)-1
C. 混合气体密度不变,则表明该反应已达到平衡状态 D. B的转化率为40%
【答案】C
【解析】根据化学平衡三段式列式计算,平衡时C的浓度为0.8 mol·L-1,物质的量为1.6mol
3A(g)+B(g)![]() xC(g)+2D(g)
xC(g)+2D(g)
起始量(mol) 3 1 0 0
变化量(mol) 1.2 0.4 1.6 0.8
平衡量(mol) 1.8 0.6 1.6 0.8
依据上式分析计算:
A、根据浓度变化量之比等于化学计量数之比可知x=4,故A正确;B、2min内B的反应速率=0.4mol/(2L·2min)=0.1 mol·(L·min)-1,故B正确;
C、反应前后气体总质量不变,混合气体密度不变,不能表明该反应已达到平衡状态,故C错误;D、 B的转化率=0.4mol/1mol=0.4,即 B的转化率为40%,故D正确;故选C.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
【题目】已知:常阻下,Ksp.(ZnS)=1.6×10—24;pM=—lgc(M2+)(MI2+为Cu2+或Zn2+)。常温下,向10 mL 0.10 mol/L CuCl2溶液中滴加0.10 mol/L Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )
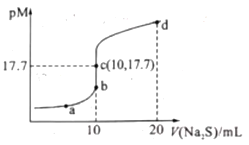
A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl—)>c(S2—)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是

A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应:mA(g)+nB(g)![]() xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )
xC(g) ΔΗ=Q kJmol-1,在密闭容器中进行,表示反应在不同时间t,温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则( )

A.T1>T2,P1>P2,m+n>x,Q>0B.T1<T2,P1<P2,m+n<x,Q>0
C.T1>T2,P1<P2,m+n<x,Q<0D.T1<T2,P1<P2,m+n>x,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。向NaCN溶液中通入少量的H2S气体,反应的化学方程式为__________。
(2)在一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_____(用含a和b的代数式表示)。
(3)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,则25 ℃时,0.1 mol·L-1NaHC2O4显____性,理由是___,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液中c(H+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小顺序为______(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度的大小顺序为________。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,温度升高,Ka将______(填“变大”、“不变”或“变小”,下同),加入少量CH3COONa后c(H+) _________,Ka________,原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:

(1)该反应的化学方程式为___________________________。
(2)反应开始至2 min,用Y表示的平均反应速率为_________,X的转化率为________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是_______。
A.X、Y、Z的浓度相等 |
B.X、Y、Z的分子数比为3︰1︰2 |
C.Z的生成速率是Y的生成速率的二倍 |
D.单位时间内生成n mol Y,同时生成3n mol X |
(4)在密闭容器里,通入a mol A(g)和b mol B(g),
发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是________(填序号)。
①降低温度
②保持容器的体积不变,充入氦气
③加入催化剂
④保持容器的体积不变,增加A(g)的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂离子电池,在室温条件下可进行循环充放电,实现对磁性的可逆调控。一极为纳米Fe2O3,另一极为金属锂和石墨的复合材料,电解质只传导锂离子。电池总反应为:Fe2O3+6Li![]() 2Fe+3Li2O,关于此电池,下列说法不正确的是
2Fe+3Li2O,关于此电池,下列说法不正确的是
A.放电时,此电池逐渐靠近磁铁
B.放电时,正极反应为Fe2O3+6Li++6e-= 2Fe+3Li2O
C.放电时,正极质量减小,负极质量增加
D.充电时,阴极反应为Li++e-=Li
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①![]()
![]()
②![]()
![]()
在不同温度时![]() 、
、![]() 的值如表:
的值如表:
温度 |
|
|
973 |
|
|
1173 |
|
|
据此可知反应③:“![]()
![]() ”的相关信息正确的是( )
”的相关信息正确的是( )
A.![]()
B.该反应正反应为吸热反应
C.该反应进行时不断分离出![]() ,可以提高
,可以提高![]() 的转化率和反应速率
的转化率和反应速率
D.在恒温且容积可变的容器中发生反应③,压缩体积反应速率会增大,![]() 也增大
也增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com