
【题目】按要求计算并填空
(1)32gSO2标况下的体积为____________L,含有______________个氧原子。
(2)1.204×1023个NH3分子所含的氢原子数与________mol CH4含有的氢原子数相同。
(3)标况下,某CO2和H2混合气体的密度为1.25g/L,则混合气体中CO2和H2的体积比约为______________。
(4)200 mL某硫酸盐溶液中含SO42- 1.5 NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为________mol/L。
(5)把VmL含有Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入含足量NaOH的溶液并加热,铵根离子完全反应生成a mol NH3(已知NH4++OH-![]() NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
NH3↑+H2O);另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中Al3+的浓度为_____________mol/L。
(6)将20.0g质量分数为14.0%的 NaNO3溶液与30.0g质量分数为24.0%的NaNO3溶液混合,得到的密度为1.15g/cm3的混合溶液。混合后溶液的物质的量浓度为______(结果保留1位小数)。
【答案】11.2 6.02×1023或NA 0.15 13:8 2.5 ![]() 2.7mol/L
2.7mol/L
【解析】
(1)32gSO2标况下的体积为![]() 11.2L,含有氧原子数
11.2L,含有氧原子数![]() NA。
NA。
(2)1.204×1023个NH3分子的物质的量是![]() , 所含的氢原子数的物质的量是0.6mol,含有的氢原子数相同的CH4的物质的量是
, 所含的氢原子数的物质的量是0.6mol,含有的氢原子数相同的CH4的物质的量是![]() 0.15mol 。
0.15mol 。
(3)标况下,某CO2和H2混合气体的密度为1.25g/L,混合气体的平均摩尔质量是1.25g/L×22.4L/mol=28g/mol,设CO2和H2的物质的量分别是xmol、ymol,![]() ,
,![]() ,则混合气体中CO2和H2的体积比约为13:8。
,则混合气体中CO2和H2的体积比约为13:8。
(4)200 mL某硫酸盐溶液中含SO42- 1.5 NA个,含金属离子NA个,则SO42- 、金属离子的物质的量分别是1.5mol、1mol,该盐的化学式可表示为R2(SO4)3,该硫酸盐的物质的量是0.5mol,则该硫酸盐溶液的物质的量浓度为![]() =2.5mol/L。
=2.5mol/L。
(5)一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,说明硫酸根离子的物质的量为bmol;一份加入足量NaOH的溶液并加热,生成amol NH3,则(NH4)2SO4的物质的量是![]() mol ;则Al2(SO4)3的物质的量是
mol ;则Al2(SO4)3的物质的量是![]() mol,Al3+的物质的量是
mol,Al3+的物质的量是![]() mol,原混合溶液中Al3+的浓度为
mol,原混合溶液中Al3+的浓度为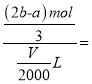
![]() mol/L。
mol/L。
(6)混合后溶质的物质的量是![]() ,混合后溶液的体积是
,混合后溶液的体积是![]() ,物质的量浓度为0.118mol÷0.043L=2.7mol/L。
,物质的量浓度为0.118mol÷0.043L=2.7mol/L。


科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。
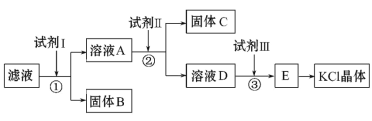
回答下列问题:
(1)试剂Ⅰ的化学式为_______,
(2)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是_____。
(3)试剂Ⅲ的名称是_________,③中发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。每位考生只可选做1题,若两题都作答,则以A题计分。
A.《化学与生活》
(1)材料与人类吃、穿、住、行、用、医疗、通信等密切相关
①下列分子式或结构简式可表示维生素C的______(填字母)。
a.C6H8O6 b.C6H10O6 c.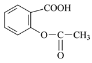
②玻璃钢门窗被国际上称为继木、钢、铝、塑之后的第五代门窗产品。玻璃钢属于下列材料中的____(填字母)。
a.金属材料 b.无机非金属材料 c. 复合材料
③黏土是陶瓷的生产原料,其主要组成可表示为Al2Si2Ox(OH)4,则x=______(填字母)。
a.1 b.3 c.5
(2)绿色发展可使 “天更蓝,水更清,空气更清新,生活更美好”。
①传统的一次性塑料袋有聚氯乙烯、氯乙烯等,它们在环境中难降解易造成白色污染,合成聚氯乙烯的单体为_____(写结构简式)。
②燃煤产生的NO2是形成硝酸型酸雨的元凶,在催化剂及加热条件下用NH3与NO2反应可生成无毒无污染的气体,该反应的化学方程式为______。
③含铬(Cr2O72ˉ)的酸性废水处理方法之一可采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和______。处理后的废水中因含有大量_____(填离子符号),能导致水体富营养化,还需进一步处理。
(3)保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段。
①有些氨基酸人体自身不能合成,要从外界才能获得,这些氨基酸称为________。苹果中含有一定量的铁元素,人体缺铁会导致的疾病是_____。
②含碘食盐中添加有KIO3,可用KI、盐酸及淀粉溶液检验,该反应的离子方程式为_______。
③人类历史上最重要的抗生素是_____(填名称);“铝镁加”是一种新型的抗酸剂,它的主要成分的化学式为:Al2Mg6(OH)14(CO3)2·4H2O,它与胃酸主要成分反应的化学方程式为______。
B.《有机化学基础》
(1)有机化合物的结构对其性质有着重要的影响。
①下列有机物易溶于水的是____(填字母)。
a. 乙烷 b.乙醇 c.乙酸乙酯
②下列有机物常温下呈气态的是_____(填字母)。
a.正丁烷 b.苯 c.溴乙烷
③分子式为C2H4O2的有机物中既能发生银镜反应又能发生水解反应的是_____(填字母)。
a.CH3COOH b.HOCH2CHO c. HCOOCH3
(2)芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:

①化合物Ⅱ中含氧官能团为____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
(3)囧烷(E)的一种合成路线如下:
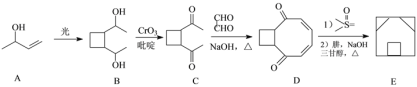
①A→B的反应类型为_____;B中手性碳原子数目为_____(填数字)。
②E的分子式______;A可用于合成一种常见的人造橡胶的单体,由A制备该单体的化学方程式为______。
③满足下列条件的D的同分异体的结构简式为_____。
Ⅰ.含有1个苯环,无其它环状结构,能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有4组峰且面积比为3∶3∶2∶2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在528K、固定计提的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值。
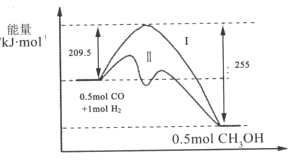
(1)该反应的热化学方程式为______;
(2)若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为______;
(3)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施______;(答出两项即可)
(4)关于反应历程Ⅰ与反应历程Ⅱ相比较,下列说法正确的是______;
A.反应历程Ⅱ比反应历程Ⅰ放出的热量少
B.反应历程Ⅱ比反应历程Ⅰ反应速率快
C.反应历程Ⅱ比反应历程Ⅰ平衡常数小
D.反应历程Ⅱ和反应历程Ⅰ中CO转化率相同
Ⅱ、已知:N2(g)+3H2(g)2NH3(g)△H=-92.1kJ/mol,在容器中充入1.4mol/LN2与4 mol/LH2,其中N2与NH3在达到平衡后改变某条件下的浓度变化如图所示
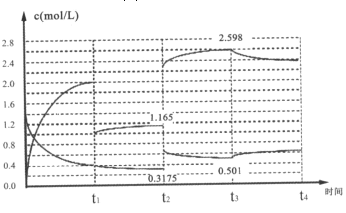
(5)t2时刻改变的条件为______;
(6)t2=t3时刻的平衡常数为______(mol/L)-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。
回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。
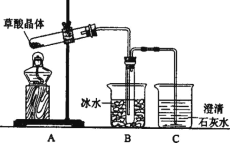
若草酸晶体分解的产物中有CO2,则装置C中可观察到的现象是_____________________,装置B的主要作用是____________________________________。
(2)乙组同学认为草酸晶体分解产物除CO2外还有CO,为进一步验证CO的存在,选用甲组实验中的装置A、B和下图所示部分装置(可以重复选用)进行实验,装置G干燥管中装有的无水氯化钙是干燥剂,可以除去气体中的水分。



①乙组同学的实验装置中,依次连接的合理顺序为A、B、__________________。装置H硬质玻璃管中盛有的物质是______________________。
②能证明草酸晶体分解产物中有CO的现象是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃结构简式为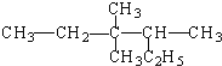 ,其命名正确的是
,其命名正确的是
A. 2-乙基-3,3-二甲基戊烷 B. 3,3-二甲基-4-乙基戊烷
C. 3,3,4-三甲基己烷 D. 3,4,4-三甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为( )
A.![]() (A+N-10)molB.
(A+N-10)molB.![]() (A-N+6)mol
(A-N+6)mol
C.(A-N+2)molD.![]() (A-N+8)mol
(A-N+8)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入2mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
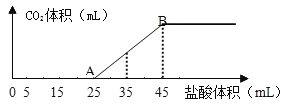
(1)写出OA段所发生反应的离子方程式____、____。
(2)当加入45mL盐酸时,产生CO2的体积为___mL(标准状况)。
(3)混合物中氢氧化钠质量分数是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com