
| A. | 活性炭有还原性,可用作制糖业脱色剂 | |
| B. | 二氧化氯有强氧化性,可用于饮用水消毒 | |
| C. | 氯化铁溶液呈酸性,可用于蚀刻铜电路板 | |
| D. | 晶体硅的熔点高、硬度大,可用于制作半导体材料 |
分析 A.活性炭使糖脱色与吸附性有关;
B.具有强氧化性,可使蛋白质变性;
C.氯化铁与Cu反应生成氯化亚铁和氯化铜;
D.单质硅的导电性介于导体和绝缘体之间.
解答 解:A.活性炭使糖脱色与吸附性有关,与还原性无关,故A错误;
B.二氧化氯有强氧化性,可使蛋白质变性,可用于杀菌消毒,故B正确;
C.氯化铁与Cu反应生成氯化亚铁和氯化铜,反应中氯化铁表现氧化性,与溶液的酸性无关,故C错误;
D.单质硅的导电性介于导体和绝缘体之间,是良好的半导体材料,与单质硅的熔沸点和硬度无关,故D错误.
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,由A生成F的反应类型是加聚反应.
,由A生成F的反应类型是加聚反应. CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 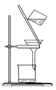 装置可用于提纯胶体 | |
| B. | 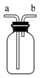 装置可用于排空气法收集气体,可收集CO2、NH3、H2等 | |
| C. |  装置可用于吸收SO2 | |
| D. |  装置可用验证浓硫酸具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )
锌-空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时下列说法正确的是( )| A. | 氧气在石墨电极上发生氧化反应 | |
| B. | 该电池的负极反应为Zn+H2O-2e-=ZnO+2H+ | |
| C. | 该电池放电时OH-向石墨电极移动 | |
| D. | 该电池充电时应将Zn电极与电源负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | Ag2CO3白色悬浊液中滴加少量Na2S溶液,出现黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
| B | 向某溶液中加入氯化钡溶液,产生白色沉淀,再加入过量的稀盐酸,沉淀不溶解 | 该溶液中一定含有SO42- |
| C | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | CO32-结合质子的能力比C6H5O-强 |
| D | 向溶液X中加入Na2O2粉末,出现红褐色沉淀和无色气泡 | X中一定含有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeC13溶液中:A13+、NH4+、Cl-、SCN- | |
| B. | 使甲基橙变红色的溶液中:Mg2+、K+、SO42-、NO3- | |
| C. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-15mol/L的溶液中:Na+、Fe3+、I-、AlO2- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液与醋酸钠溶液中的醋酸根均可以水解,同浓度时前者的水解程度比后者低一些 | |
| B. | 明矾净水与自来水的杀菌清毒原理是一样的 | |
| C. | MgO和Al2O3在工业上用于制作耐高温材料,可用电解此两种物质冶炼镁、铝金属 | |
| D. | 氯化亚铁溶液加热蒸干并灼烧得到三氧化二铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
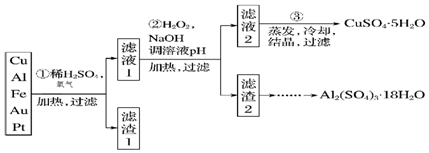
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com