
分析 (1)根据实验操作步骤确定每步操作需要仪器,然后判断还缺少仪器名称;
(2)根据配制步骤判断玻璃棒的作用;
(3)根据实验操作的步骤计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作排序;
(4)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
解答 解:(1)配制0.1mol/L的NaOH溶液500mL,配制步骤有称量、溶解、移液、洗涤移液、定容、摇匀等操作,用天平称量NaOH(用到药匙),在烧杯中稀释,并用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以给出的仪器必须使用的仪器有acde;还需要的仪器:胶头滴管,
故答案为:acde;胶头滴管;
(2)实验中两次用到玻璃棒,溶解氢氧化钠溶液时需要使用玻璃棒搅拌、转移溶液时用玻璃棒引流,
故答案为:搅拌;引流;
(3)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:②①③⑧⑤⑥⑦④;
故答案为:②①③⑧⑤⑥⑦④;
(4)密度为1.8g/mL、质量分数为98%的浓硫酸,物质的量浓度C=$\frac{1000×1.8×98%}{98}$=18mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:V×18mol/L=1000mL×0.18mol/L,解得V=10.0mL;
故答案为:10.0.
点评 本题考查配制一定物质的量浓度溶液的实验操作步骤和仪器,熟悉配制原理和操作步骤是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量为98g | |
| B. | 1molH2SO4的质量为98g/mol | |
| C. | 标准状况下2molO2的体积约为44.8L | |
| D. | 室温常压下气体摩尔体积约为22.4L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3A+B=C | B. | 2A+2B=3C | C. | 4A+6B=9C | D. | 9A+6B=4C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
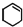 )为原料合成,路线如下(部分反应条件省略):
)为原料合成,路线如下(部分反应条件省略):
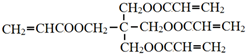
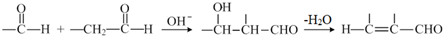

 的化学方程式是
的化学方程式是 .
.
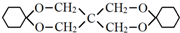 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素H只有${\;}_1^1$H和${\;}_1^2$H两种核素 | |
| B. | Cl2、NH4Cl中氯元素微粒的半径:r(Cl)>r(Cl-) | |
| C. | 工业上常用干燥的钢瓶储存液氯,是因为铁和氯气在任何条件下都不反应 | |
| D. | 该反应表明常温下氯气有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com