
| 实验序号 | 0.1mol/L NaClO溶液/mL | 0.1mol/L NaCl溶液/mL | 0.2mol/L NaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | 4.0 | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
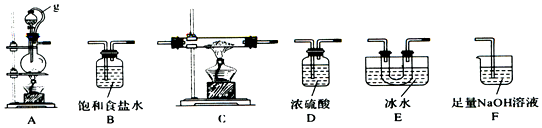
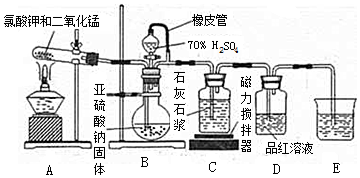
分析 用氯气和单质硼反应制备三氯化硼:在加热条件下,二氧化锰和浓盐酸发生氧化还原反应生成Cl2,但浓盐酸具有挥发性,水被加热也能蒸发,升高温度加快浓盐酸挥发、加快水蒸发,所以生成的Cl2中含有HCl、H2O,浓硫酸具有吸水性,饱和食盐水能吸收Cl2,浓硫酸能干燥气体,从而得到较纯净的Cl2,防止生成的B和HCl、BCl3水解;C中制得BCl3,然后用E得到BCl3固体,为防止生成的BCl3水解E装置之后需要干燥装置,F吸收未反应的Cl2,据此分析解答.
解答 解:(1)A中二氧化锰和浓盐酸发生氧化还原反应生成Cl2,生成的Cl2中含有HCl、H2O,故连接B装置用饱和食盐水吸收氯化氢,再连接D装置浓硫酸吸水干燥,C中生成BCl3,用E得到BCl3固体,为防止生成的BCl3水解E装置之后需要干燥装置D,最后用F吸收未反应的Cl2;
故答案为:B;D;D;F;
(2)A中二氧化锰和浓盐酸发生氧化还原反应生成Cl2,离子方程式为:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)g管的作用是保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶,BC13的沸点为12.5℃,熔点为-107.3℃,故用E装置冰水冷凝并收集BC13;
故答案为:保持气压平衡,便于分液漏斗中的液体流入蒸馏烧瓶;冷凝并收集BC13;
(4)停止实验,先熄灭C处酒精灯,为防止倒吸,再拔F处导管,后熄灭A处酒精灯;
故答案为:先熄灭C处酒精灯,再拔F处导管,后熄灭A处酒精灯;
(5)硼酸是一元弱酸,其钠盐化学式为Na[B(OH)4〕,则硼酸在水中的电离方程式是:H3BO3+H2O═[B(OH)4]-+H+;
故答案为:H3BO3+H2O═[B(OH)4]-+H+;
(6)向F中(溶液含有0.05mol/LNaC10、0.05mol/LNaCl、0.1mol/LN a0H)滴加品红溶液,发现溶液褪色.探究溶液褪色的原因,三组对比试验应溶液总体积相同,都为8mL溶液,故实验②氢氧化钠溶液为4.0mL,实验①③褪色,说明NaClO使品红溶液褪色,实验③褪色较慢,则溶液碱性越强褪色越慢;
故答案为:4.0;NaClO使品红溶液褪色,溶液碱性越强褪色越慢.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,题目难度中等.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| M | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| N | 原子的M电子层上有3个电子 |
| W | 在短周期元素中,其原子半径最大 |
| X | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成X的单质和H2O |
| Y | 元素最高价正价与最低负价的代数和为6 |
| A. | M的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | W单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 由N和Y所形成的化合物中存在离子键,属于离子化合物 | |
| D. | N、W、X的最高价氧化物对应的水化物两两之间能相互发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
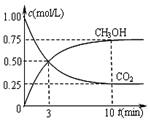 工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.
工业上以煤和水为原料通过一系列转化可变为清洁能源氢气或工业原料甲醇.| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | dacb | B. | bcad | C. | acbd | D. | dcba |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铝粉投入到NaOH溶液中:2Al+6H2O+2OH-═2 Al(OH)4-+H2↑ | |
| B. | Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-═Al(OH)4- | |
| C. | NaAl(OH)4溶液中通入足量的CO2:2 Al(OH)4-+CO2═2Al(OH)3↓+CO32-+H2O | |
| D. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2 Al(OH)4-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com