


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3molC+1molD |
| B、2molA+2molC |
| C、2molA+1molB+0.5molD |
| D、1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )
选用下列试剂和电极:稀H2SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计G的指针均明显偏转,则其可能的组合共有( )| A、6种 | B、5种 | C、4种 | D、3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,0.01mol/L氢氰酸溶液的pH大于2 |
| B、HCN溶液用水稀释后,氢离子浓度下降 |
| C、NaCN溶液呈碱性 |
| D、相同条件下,0.01mol/L氢氰酸溶液的导电性比0.01 mol/L 氯化氢溶液的差 |
查看答案和解析>>
科目:高中化学 来源: 题型:
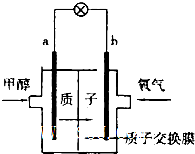 某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:
某研究性学习小组为了证明某酸HmA是强酸还是弱酸,设计了如下实验方案,请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同浓度的H2SO4溶液于KOH溶液 |
| B、pH=3的盐酸和pH=11的氨水 |
| C、pH=3的硫酸和pH=11的KOH |
| D、pH=3的醋酸和pH=11的KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、c(H+)=c(OH-)=10-6mol/L溶液 |
| C、由强酸、强碱等物质的量反应后得到的溶液 |
| D、滴入甲基橙指示剂显橙色的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com