
 ,NaH与水反应可放出气体为氢气,同时生成NaOH,该反应的化学方程式为 NaH+H2O=NaOH+H2↑,
,NaH与水反应可放出气体为氢气,同时生成NaOH,该反应的化学方程式为 NaH+H2O=NaOH+H2↑, ;NaH+H2O=NaOH+H2↑;
;NaH+H2O=NaOH+H2↑;
| ||
| 冰晶石 |
| ||
| 冰晶石 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、①③④ | B、③④⑤ |
| C、②③④ | D、①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量是一个基本物理量,表示物质所含粒子的多少 |
| B、1mol氢中含有2mol氢原子和2mol电子 |
| C、1molH2O的质量等于NA个H2O质量的总和(NA表示阿伏加德罗常数) |
| D、摩尔表示物质的量的数量单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、1:3 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
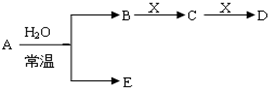
查看答案和解析>>
科目:高中化学 来源: 题型:
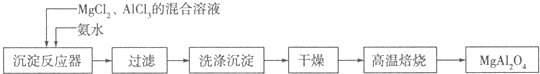

查看答案和解析>>
科目:高中化学 来源: 题型:
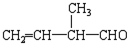 所含官能团的名称是
所含官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子方程式 | 结论 |
| A | AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | 溶解度:AgI>AgCl |
| B | Fe2++H2O2+2H+═Fe3++2H2O | 氧化性:H2O2>Fe3+ |
| C | CO32-+CO2+H2O═2HCO3- | 稳定性:HCO3->CO32- |
| D | NH3+H3O+═NH4++H2O | 得质子能力:NH3>H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com