
| A. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 | |
| B. | 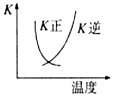 2SO2(g)+O2(g)?2SO3(g)△H<0的正、逆反应的平衡常数K随温度的变化可用图表示 | |
| C. | 2NO+2CO?2CO2+N2 △H<0,常温下该反应一定能自发进行 | |
| D. | FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3 |
分析 A.醋酸抑制水的电离,氯化铵促进水的电离;
B.该反应为放热反应,升高温度平衡逆向移动,逆反应的K增大,正反应的K减小;
C.△H-T△S<0的反应可自发进行;
D.FeCl3溶液水解生成的盐酸易挥发,而Fe2(SO4)3溶液水解生成的硫酸不挥发.
解答 解:A.醋酸抑制水的电离,氯化铵促进水的电离,则pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度不同,故A错误;
B.该反应为放热反应,升高温度平衡逆向移动,逆反应的K增大,正反应的K减小,与图中K的变化一致,故B正确;
C.△H-T△S<0的反应可自发进行,△H<0、△S<0,低温下可进行,高温下不能自发进行,故C错误;
D.FeCl3溶液水解生成的盐酸易挥发,而Fe2(SO4)3溶液水解生成的硫酸不挥发,则只有FeCl3溶液加热蒸干灼烧都得到Fe2O3,故D错误;
故选B.
点评 本题考查较综合,涉及弱电解质的电离、平衡移动、反应进行方向、盐类水解,为高频考点,把握化学反应原理为解答的关键,侧重分析与用语能力的考查,注意选项C为解答的难点,综合性较强,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 min | B. | 3 min | C. | 6 min | D. | 9 min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3一四甲基丁烷 | B. | 2,3,4一三甲基戊烷 | ||
| C. | 3,4一二乙基己烷 | D. | 2,2一二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
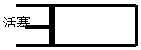 如图,标准状况下,向带有活塞最大容积为120L的密闭容器中充入a mol H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )
如图,标准状况下,向带有活塞最大容积为120L的密闭容器中充入a mol H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )| A. | 14.40 | B. | 8.00 | C. | 5.60 | D. | 2.86 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
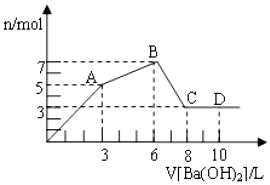 向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中A点生成的沉淀是BaSO4和Al(OH)3 | |
| B. | 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2 | |
| C. | AB段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO42-═BaSO4↓+2AlO2-+4H2O | |
| D. | 向D点溶液中通入CO2气体,立即产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com