
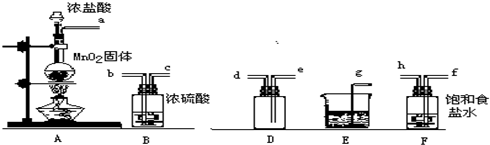
 MnCl2+Cl2↑+2H2O,其离子方程式是MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,其离子方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O.
Mn2++Cl2↑+2H2O. Mn2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O;
Mn2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O; ═0.2mol,根据MnO2+4HCl
═0.2mol,根据MnO2+4HCl MnCl2+Cl2↑+2H2O可知,2mol二氧化锰参加反应能生成0.2molCl2,根据Cl2+2KI=2KCl+I2可知,0.2molCl2反应能生成
MnCl2+Cl2↑+2H2O可知,2mol二氧化锰参加反应能生成0.2molCl2,根据Cl2+2KI=2KCl+I2可知,0.2molCl2反应能生成

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:阅读理解
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com