
| A.CS2分子的立体构型为V形 |
B.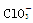 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有每个原子均满足最外层8电子稳定结构 |
D.SiF4和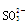 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
科目:高中化学 来源:不详 题型:单选题
A.BF3和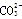 是等电子体,均为平面正三角形结构 是等电子体,均为平面正三角形结构 |
| B.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道 |
| C.NH3和PCl3是等电子体,均为三角锥形结构 |
D.CH4和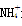 是等电子体,键角均为60° 是等电子体,键角均为60° |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.水溶液能导电 | B.由金属和非金属元素的原子组成 |
| C.熔融状态能导电 | D.可以溶于水并放出热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CS2为V形的极性分子 |
| B.电子云示意图中的每个小黑点都表示一个电子 |
| C.非极性键也可以存在于化合物中 |
| D.甲烷、氨和水都是由极性键结合而成的极性分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的化合物N5AsF6,下列叙述错误的是
的化合物N5AsF6,下列叙述错误的是A.N 共有34个核外电子 共有34个核外电子 |
B.N 中氮-氮原子间以共用电子对结合 中氮-氮原子间以共用电子对结合 |
| C.化合物N5AsF6中As化合价为+1 |
| D.化合物N5AsF6中F化合价为-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C60是一种新型的化合物 |
| B.C60和石墨都是碳的同素异形体 |
| C.C60中虽然没有离子键,但固体为离子晶体 |
| D.C60相对分子质量为360 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化铝是共价化合物 |
| B.氯化铝的化学式应为Al2Cl6 |
C.氯化铝的结构式为: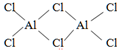 ,分子结构中有配位键 ,分子结构中有配位键 |
| D.在一定条件下,将AlCl3晶体加热至融化,熔融态的AlCl3可以导电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②④⑥ | B.④⑤⑦ | C.④⑥⑦ | D.③④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com