
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 利用下面反应H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0,不可以设计成原电池装置 |
分析 A.电解质溶液的导电过程是电解质溶液在外加直流电源作用下电解的过程;
B.电解饱和食盐水可得到氢气和氯气,二者反应生成HCl;
C.Cu与氢离子不反应;
D.自发的氧化反应可以设计成原电池.
解答 解:A.电解质溶液的导电过程是电解质溶液在外加直流电源作用下电解的过程,所以电解质溶液导电的过程实际上就是电解的过程,故A正确;
B.电解饱和食盐水可得到氢气和氯气,二者反应生成HCl,溶于水制得盐酸,故B正确;
C.Cu与氢离子不反应,所以Cu不能发生析氢腐蚀,故C错误;
D.H2SO4(aq)+BaCl2(aq)═BaSO4(s)+2HCl(aq)△H<0不是氧化还原反应,所以不能设计成原电池装置,故D正确;
故选C.
点评 本题考查了电化学方面的知识,涉及电解池和原电池原理,题目难度不大,要注重对基础知识的积累和运用,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④⑤ | C. | ①④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 成分 | 含量(mg•L-1) | 成分 | 含量(mg•L-1) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO4 2- | 2560 | Br- | 64 |
| Mg2+ | 1272 |
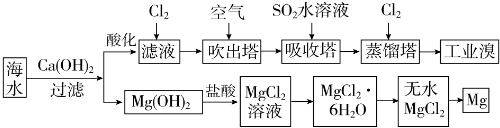
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA | |
| B. | 1mol (NH4)2Fe(SO4)2•6H2O晶体中含有离子总数为5NA | |
| C. | 常温常压下,2.24 L SO2和O2的混合气体中含有的氧原子总数为0.2 NA | |
| D. | 1 L 0.1 mol•L-1的NaHCO3溶液中含的CO32-和HCO3-总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2所含的分子数目为NA | |
| B. | 1 mol H2O含有的H2O分子数目为NA | |
| C. | 1 mol H2O含有的氢原子数目为NA | |
| D. | 0.5NA个O2分子的物质的量是0.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
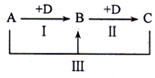 A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D表示中学化学中的四种常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水晶颗粒 | B. | 无水碳酸钠 | C. | 玻璃珠 | D. | 晶体硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2直线形 | B. | CO2平面三角形 | C. | BCl3三角锥形 | D. | CH4正四面体形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质都能发生水解反应 | |
| B. | 蔗糖溶液中加入新制Cu(OH)2煮沸会析出砖红色沉淀 | |
| C. | 纤维素、淀粉都可用(C6H10O5)n表示,它们互为同分异构体 | |
| D. | 人体各种组织的蛋白质不断分解,最终生成二氧化碳和水,排出体外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com