
| A. | 钠和水反应 | B. | 过氧化钠和水反应 | ||
| C. | 氧化钠和水反应 | D. | 二氧化碳和水 |
分析 有元素化合价变化的反应为氧化还原反应,水中H、O元素的化合价都没有变化时水既不做氧化剂又不做还原剂,以此来解答.
解答 解:A.2Na+2H2O═2NaOH+H2↑中,Na元素的化合价升高,水中H元素的化合价降低,属于氧化还原反应,水作氧化剂,故A错误;
B.2Na2O2+2H2O═4NaOH+O2↑中,Na2O2中O元素的化合价既升高又降低,属于氧化还原反应,水中H、O元素的化合价都没有变化时水既不做氧化剂又不做还原剂,故B正确;
C.氧化钠与水的反应为:Na2O+H2O═2NaOH,该反应中没有化合价变化,不属于氧化还原反应,故C错误;
D.CO2与H2O反应生成H2CO3,该反应中没有元素的化合价变化,则不属于氧化还原反应,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及氧化还原反应基本概念为解答的关键,侧重氧化剂、还原剂判断的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
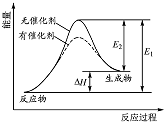
| A. | 该反应的反应物总能量高于生成物总能量 | |
| B. | 使用催化剂可以增大该反应的反应热 | |
| C. | 该化学反应的反应热为E1,且反应放热 | |
| D. | 化学反应在物质变化的同时,必然伴随能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10 mL 量筒量取 7.50 mL 稀盐酸 | |
| B. | 用托盘天平称取 25.20 g NaCl晶体 | |
| C. | 用广范 pH试纸测得某碱溶液的pH为12.7 | |
| D. | 用25 mL 碱式滴定管量取14.80 mL NaOH 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4g氢氧化钠溶于水,电离出的离子总数为2NA | |
| B. | 35.5g氯气中所含的原子数为2NA | |
| C. | 0.1mol钠变成钠离子时,失去的电子数目0.1NA | |
| D. | 实验室制氯气,得到2.24L(标准状况下)氯气时电子转移数0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:
如图所示装置中,已知B中隔板上放的是石灰石,若当打开活塞时,烧杯中的蜡烛燃烧得更旺,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | A | B | C | D |
| 相关的原子结构与性质 | 元素符号为At,与稀有气体元素相邻,但半径比I大 | 其在周期表的周期数和族序数比K的均大1 | 元素符号为Tl,名称是铊,原子核外有六个电子层,与Al同主族 | 可形成双原子分子,分子内有叁键 |
| A. | 元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定 | |
| B. | 常温下B的单质能与冷水发生剧烈反应,其硫酸盐可能易溶于水 | |
| C. | 铊氧化物化学式为Tl2O3,是离子化合物,Tl2O3和Tl(OH)3均是两性的物质 | |
| D. | 元素D的一些氧化物在大气中会产生光化学烟雾,还会破坏臭氧层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水蒸发制海盐的过程中只发生了物理变化 | |
| B. | 加入明矾,使海水的盐分沉淀并淡化 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| D. | 大海中含有钾、溴、碘等元素,需经过氧化还原反应才可得到钾、溴、碘的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com