
【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
【答案】15.4% 8 94.1 6.8 1:2 1.2
【解析】
(1)根据体积分数的定义解析;
(2)列出三段式,用![]() 求出反应的二氧化硫;
求出反应的二氧化硫;
(3)根据反应前后的氧气差,求出应加入和空气的量,再根据速率比等于物质的量之比求角;
(4)本反应历程是:OH-首先是和NH4HSO3中的H+反应,随后有多的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO3的量也增大,放出的氨气的量会为0.浓硫酸增加的质量就是氨气的质量.第一次和第二次放出的氨气的量是一样的,所以说第一次肯定是OH-的量过量.利用第二次的量计算(因为是OH-不足)。
(1)设1mol空气中N2、O2的分别为0.8mol和0.2mol,由4FeS2+11O2![]() 2Fe2O3+8SO2 ,0.2molO2可获得SO2为
2Fe2O3+8SO2 ,0.2molO2可获得SO2为![]() ,所得气体中SO2的体积分数不超过
,所得气体中SO2的体积分数不超过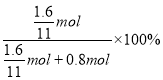 =15.4%(保留一位小数)。
=15.4%(保留一位小数)。
故答案为:15.4%;
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则:
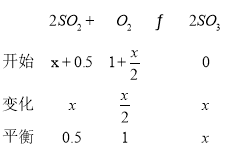
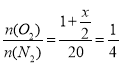 ,x=8,此时反应中SO2的转化率为
,x=8,此时反应中SO2的转化率为![]() =94.1%(保留一位小数)。
=94.1%(保留一位小数)。
故答案为:8;94.1;
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则通入的空气中的氧气为8×4-1=31,空气为31×5=155,![]() 则再往接触室里通入的空气的流速应为v=6.8m3/s(保留一位小数;气体体积在同温同压下测定)。
则再往接触室里通入的空气的流速应为v=6.8m3/s(保留一位小数;气体体积在同温同压下测定)。
故答案为:6.8;
(4)本反应历程是:OH-首先是和NH4HSO3中的H+反应,随后有多的OH-再和NH4+反应放出氨气,所以随着铵盐的量的增大,NH4HSO3的量也增大,放出的氨气的量会为0,浓硫酸增加的质量就是氨气的质量,第一次和第二次放出的氨气的量是一样的,所以说第一次肯定是OH-的量过量,利用第二次的量计算(因为是OH-不足)。
设:(NH4)2SO3的物质的量为a,NH4HSO3的物质的量为b,
116a+99b=3.140(质量守恒)…①
17(2a+b)=0.680(元素守恒)…②
解得a=0.010mol,b=0.020mol,即(NH4)2SO3和NH4HSO3的物质的量之比为1:2;
再根据(NH4)2SO3~2NaOH,NH4HSO3~NaOH,可算出x=1.2mol·L-1.
故答案为:1:2;1.2。


科目:高中化学 来源: 题型:
【题目】已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l)+2600kJ
②2C6H6(g)+15O2(g)→12CO2(g)+6H2O(l)+6590kJ
下列说法正确的是
A.2mol C2H2(g) 完全燃烧生成气态水时放热大于2600kJ
B.2mol C6H6(l) 完全燃烧生成液态水时放热大于6590kJ
C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D.C2H2(g) 三聚生成C6H6(g) 的过程属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物对环境具有显著影响。
(1)已知汽车气缸中氮及其化合物发生如下反应:
N2(g)+O2(g)![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
N2(g)+2O2(g)![]() 2NO2(g) △H=+68 kJ/mol
2NO2(g) △H=+68 kJ/mol
则 2NO(g)+O2(g)![]() 2NO2(g) △H=__________ kJ/mol
2NO2(g) △H=__________ kJ/mol
(2)对于反应2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
第一步:2NO(g)![]() N2O2(g)(快速平衡)
N2O2(g)(快速平衡)
第二步:N2O2(g)+O2(g)![]() 2NO(g)(慢反应)
2NO(g)(慢反应)
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是__________
A. 整个反应的速率由第一步反应速率决定
B. 同一温度下,平衡时第一步反应的![]() 越大,反应正向程度越大
越大,反应正向程度越大
C. 第二步反应速率慢,因而平衡转化率也低
D. 第二步反应的活化能比第一步反应的活化能高
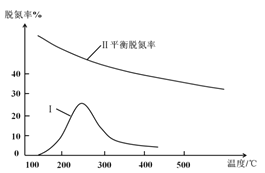
(3)在密闭容器中充入一定量的CO和NO气体,发生反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H<0,图为平衡时NO的体积分数与温度、压强的关系:
2CO2(g)+N2(g) △H<0,图为平衡时NO的体积分数与温度、压强的关系:
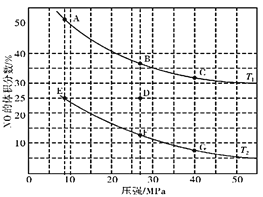
①温度:T1__________T2(填“>”、“<”或“=”)。
②若在D点对反应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的__________点(填字母)。
③某研究小组探究该反应中催化剂对脱氮率(即NO转化率)的影响。将相同量的NO和CO 以一定的流速分别通过催化剂a和b,相同时间内测定尾气,a结果如图中曲线I所示。已知:催化效率 b>a;b的活性温度约450℃。在图中画出b所对应的曲线(从300℃开始画) _______。
(4)在汽车的排气管上加装催化转化装置可减少NOx的排放。研究表明,NOx的脱除率除与还原剂、催化剂相关外,还取决于催化剂表面氧缺位的密集程度。以La0.8A0.2BCoO3+X(A、B 均为过渡元素)为催化剂,用H2还原NO的机理如下:
第一阶段:B4+(不稳定)+H2→低价态的金属离子(还原前后催化剂中金属原子的个数不变)
第二阶段:I . NO(g)+□→NO(a)
II . 2NO(a)→2N(a)+O2(g) III. 2N(a)→N2(g)+2□
IV. 2NO(a)→N2(g)+2O(a) V. 2O(a)→O2(g)+2□
注:□表示催化剂表面的氧缺位,g表示气态,a表示吸附态
第一阶段用氢气还原 B4+得到低价态的金属离子越多,第二阶段反应的速率越快,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为150mL
D.溶解合金时收集到NO气体的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质。
(1)请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式:
________________________________________________________________;
(2)上述所写反应中,硝酸表现出的化学性质是_____,被还原的元素是_______。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是______(填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为____________。
(4)若六种物质组成一个完整的化学反应,且没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】垃圾是放错了位置的资源。郑州市从2019年12月1日起开始实施垃圾分类。垃圾主要分为可回收垃圾、有害垃圾、厨余垃圾和其他垃圾四类。
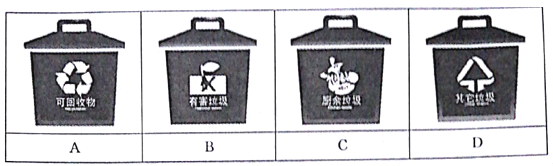
(1)小明在整理房间时,清理出如下物品:废作业本、镍镉电池、汽水易拉罐、生锈铁钉、矿泉水瓶、烂苹果、涂改液瓶、过期药片。其中镍镉电池和汽水易拉罐分别投入___和___垃圾桶中(填“A”、“B”、“C”、“D”)。
(2)生锈铁钉属于可回收垃圾。铁生锈的实质是铁失去电子被氧化。为探究金属的腐蚀条件,小明同学做了以下五个对照实验。
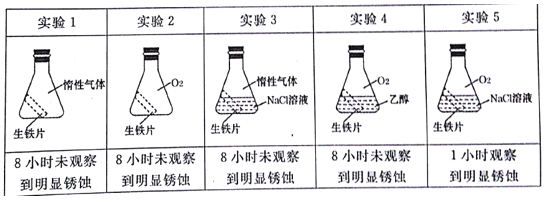
由以上实验可知,金属腐蚀的条件是___。请用电极反应式表示实验5得电子的反应过程___。
(3)防止金属腐蚀的方法有电化学防护、添加保护层等多种方法。如图装置,可以模拟铁的电化学防护。
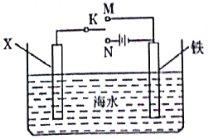
若模拟外加电流的阴极保护法,电极材料X可为碳棒,并将开关K置于N处;若模拟牺牲阳极的阴极保护法,电极材料X及相关操作为___。
(4)镀铜可防止铁制品腐蚀,请在下方方框内画出在铁制品上镀铜的实验装置示意图___。

(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于一定浓度的H2SO4溶液中,一定条件下Fe钝化形成致密的Fe3O4氧化膜,请写出该阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g) ![]() CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 |
则该反应的ΔH=_______。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为________。
②X轴上a点的数值比b点________(填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_____________________。
(3)实验室可由四氧化三铅和氢碘酸反应制备难溶的PbI2,则每生成3 mol PbI2的反应中,转移电子的物质的量为__________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3mol·L-1,则Ksp(PbI2)=_________;已知Ksp(PbCl2)=1.6×10-5,则转化反应PbCl2(s)+2I-(aq) ![]() PbI2(s)+2Cl-(aq)的平衡常数K=_________。
PbI2(s)+2Cl-(aq)的平衡常数K=_________。
(5)分解HI曲线和液相法制备HI反应曲线分别如图1和图2所示:

①反应H2(g)+I2(g) =2HI(g) 的ΔH__________(填大于或小于)0。
②将二氧化硫通入碘水中会发生反应:SO2+I2+2H2O=3H++HSO4-+2I-,I2+I-![]() I3-,图2中曲线a、b分别代表的微粒是________、_________(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________。
I3-,图2中曲线a、b分别代表的微粒是________、_________(填微粒符号);由图2 知要提高碘的还原率,除控制温度外,还可以采取的措施是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往20ml1mol/L的AlCl3溶液中滴加0.2mol/L的NaOH溶液,最后有1.17克沉淀生成,则加入NaOH溶液的体积是
A.125mLB.275mLC.325mLD.450mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在一个2L的密闭容器中,X、Y、Z三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

①该反应的化学方程式为____________________________。
②从开始至2min,Z的平均反应速率为________________。
③若要提高X的转化率,请提出两条合理措施_______________________________、____________________________。
II.某探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到实验数据如表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL氢气 所需时间/s |
Ⅰ | 薄片 | 15 | 200 |
Ⅱ | 薄片 | 25 | 90 |
Ⅲ | 粉末 | 25 | 10 |
①该实验的目的是探究__________、__________对锌和稀盐酸反应速率的影响;
②实验Ⅰ和Ⅱ表明__________,化学反应速率越大;
③能表明固体的表面积对反应速率有影响的实验编号是 ______ 和 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com