

分析 (1)洗涤晶体表面的杂质离子,同时减少晶体的损失;
(2)实验①中将气体通过碱石灰吸收水蒸气;
(3)用0.10mol/LMnO4酸性溶液滴定溶液中的Fe2+,利用滴入最后一滴高锰酸钾溶液的紫红色指示反应终点;高锰酸钾酸性溶液氧化亚铁离子生成铁离子;
(4)称取11.76晶体分成三等份,进行如下实验;
①一份与足量的熟石灰混合加热,将产生的气体依次通过石灰和浓硫酸,浓硫酸增重0.34g是吸收的氨气;
②一份溶于水,滴入过量的BaCl2溶液,测得生成沉淀4.66g,据此计算硫酸根离子物质的量;
③一份溶于水,用0.10mol/LMnO4酸性溶液滴定溶液中的Fe2+,滴至终点时消耗KMnO4酸性溶液20.00mL,结合氧化还原反应定量关系计算亚铁离子物质的量,
根据微粒物质的量之比写出晶体的化学式.
解答 解:(1)制备晶体时,不用水而用酒精洗涤晶体的原因是晶体在酒精中溶解度小于水中溶解度,减少洗涤时晶体的损失,
故答案为:晶体在酒精中溶解度小于水中溶解度,减少洗涤时晶体的损失;
(2)实验①中将气体通过碱石灰的目的是吸收气体中的水蒸气,
故答案为:吸收气体中的水蒸气;
(3)用0.10mol/LMnO4酸性溶液滴定溶液中的Fe2+,滴至终点时消耗KMnO4酸性溶液20.00mL,滴定终点的现象为:滴入最后一滴KMnO4酸性溶液,溶液由黄色变化为紫红色,且半分钟内不变色,滴定中反应的离子方程式为:5Fe2++2MnO4-+8H+=2Mn2++5Fe3++4H2O,
故答案为:滴入最后一滴KMnO4酸性溶液,溶液由黄色变化为紫红色,且半分钟内不变色;5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O;
(4)①一份与足量的熟石灰混合加热,将产生的气体依次通过石灰和浓硫酸,浓硫酸增重0.34g是吸收的氨气,n(NH4+)=n(NH3)=$\frac{0.34g}{17g/mol}$=0.02mol;
②一份溶于水,滴入过量的BaCl2溶液,测得生成沉淀4.66g,据此计算硫酸根离子物质的量n(SO42-)=n(BaSO4)=$\frac{4.66g}{233g/mol}$=0.02mol;
③一份溶于水,用0.10mol/LMnO4酸性溶液滴定溶液中的Fe2+,滴至终点时消耗KMnO4酸性溶液20.00mL,结合氧化还原反应定量关系计算亚铁离子物质的量,
5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O
5 1
n 0.10mol/L×0.0200L
n(Fe2+)=0.01mol,
则晶体中含结晶水物质的量n(H2O)=$\frac{11.76g×\frac{1}{3}-0.01mol×56g/mol-0.02mol×18g/mol-0.02mol×96g/mol}{18g/mol}$=0.06mol,
则得到n(NH4+):n(Fe2+):n(SO42-):n(H2O)=0.02:0.01:0.02:0.06=2:1:2:6,化学式为(NH4)2Fe(SO4)2•6H2O,
故答案为:(NH4)2Fe(SO4)2•6H2O.
点评 本题考查了晶体制备实验过程分析、晶体结构的计算应用,主要是离子性质的分析判断,掌握基础是解题关键,题目难度中等.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:推断题

 ;F含有的官能团名称是羧基、羟基.
;F含有的官能团名称是羧基、羟基. .
. 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过测定大米浸泡液的pH检验大米新鲜度 | |
| B. | 用含Fe2+的检测试剂检验自来水中余氯的含量 | |
| C. | 向食盐样品中加还原剂和淀粉检测食盐的含碘量 | |
| D. | 通过观察放入检测液中鸡蛋的沉浮检验鸡蛋新鲜度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{自动失水}{→}$
$\stackrel{自动失水}{→}$ +H2O
+H2O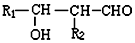
 ;G:(CH2OH)3CCHO.
;G:(CH2OH)3CCHO. .
. .
. (写一种).
(写一种).查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
某大型精炼铜厂,在电解铜的阳极泥中含有 3-14% Se 元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金 属及贵金属.从阳极泥中提取Se 的流程如下:
属及贵金属.从阳极泥中提取Se 的流程如下:

已知:SeO2在773K时为气态
(1)流程②的作用 工业提取 Se 的流程中,可循环利用的物质是
(2)H2SeO3与SO2的离子反应方程式为 .
(3)上述工业提取 Se 的流程中,SeO2、H2SO4 (浓)、SO2 的氧化性由强到弱的顺序是
(4)单质硒可能成为环境污染物,可通过与浓HNO3反应生成SeO2来回收Se,Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式: 如不对该反应还原产物的比例作限制,该反应 出现多组配平系数(填“可能”或“不可能”)
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质 | 实际应用 | |
A. | 三价铁比二价铜氧化性强 | FeCl3腐蚀Cu |
B. | 次氯酸盐具有氧化性 | 次氯酸钙可做漂白剂 |
C. | 稀硝酸可与银反应 | 稀硝酸可除去试管内壁 |
D. | HF能与Si反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
卤代烃的制备有多种方法,下列卤代烃不适合由相应的烃经卤代反应制得的是
A. B.
B.  C.
C. D.
D.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com