
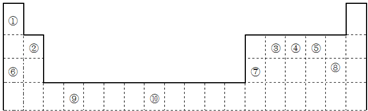
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
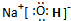 ,故答案为:HClO4;
,故答案为:HClO4;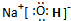 ;
;
| ||
| 高温高压 |
| ||
| 高温高压 |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验 编号 |
温度 | 金属铝 形态 |
盐酸浓度 /mol?L-1 |
| (1)实验①和②探究 (2)实验①和③探究 (3)实验①和④探究 |
① | 25℃ | 铝片 | 4.0 |
| ② | 25℃ | 铝片 | 2.0 | |
| ③ | 50℃ | 铝片 | 4.0 | |
| ④ | 25℃ | 铝粉 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| m |
| n |
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 试剂及方法 | 供选择的化学试剂及实验方法 |
| 鉴别MgCl2和AlCl3 | A、加入稀盐酸 | |
| 证明NaCl溶液中含有Na2SO4 | B、加入过量烧碱溶液 | |
| 除去Na2CO3中少量NaHCO3 | C、加热至恒重 | |
| 证明CaO粉末中含有铝粉 | D、加入BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com